
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) ![]() 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.1mol B和1mol CB.2mol A、3mol B和1mol He(He不参加反应)
C.2mol CD.2mol A、3mol B和3mol C
【答案】C
【解析】
反应2A(g)+B(g)3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中达到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,即可得到相同平衡状态,若要平衡后A的体积分数大于a%,说明平衡向左移动,根据等效平衡,把物质都换算成方程式一边的物质,满足n(A):n(B)>1:1,据此进行判断即可。
反应2A(g)+B(g)3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中达到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,为等效平衡,则:
A.1molB和1molC,相当于2/3molA和4/3molB,n(A):n(B)=1:2<1:1,A的转化率增大,则平衡后A的体积分数小于a%,故A错误;
B.2molA、3molB和1mol He,1mol He对平衡无影响,n(A):n(B)=2:3<1:1,使A的转化率增大,A的体积分数减小,故B错误;
C.若将2mol C全部转化为A、B,分别得到4/3mol A和2/3molB,n(A):n(B)=2:1>1:1,使A的转化率减小,A的体积分数增加,故C正确;
D.2molA、3molB和3molC,相当于4molA和4molB,n(A):n(B)=1:1,为等效平衡,A的转化率不变,则平衡后A的体积分数等于a%,故D错误;
答案选C。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。

回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
A.TiOSO4中钛元素的化合价为+4价 |
B.TiO2中既含有离子键,又含有共价键 |
C.钛元素位于元素周期表中IVA族 |
D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为![]()
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。 此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)![]() 2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是
2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是
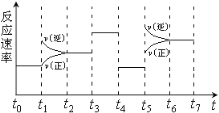
A. t6~t7阶段,C的百分含量最大
B. t2~t3阶段,A的转化率最小
C. t3时,改变因素一定是使用了催化剂
D. t5时,改变因素一定是升高了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛合金在国防、医用器材领域有重要应用,某研究小组利用钛铁矿[主要成分偏钛酸亚铁(FeTiO3),含SiO2、FeO 杂质]制取TiCl4,然后进一步制备金属钛,流程如下∶

已知∶
a.发生的主要反应方程式如下∶
FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O TiOSO4+2H2O
TiOSO4+FeSO4+2H2O TiOSO4+2H2O![]() H2TiO3↓+H2SO4
H2TiO3↓+H2SO4
H2TiO3![]() TiO2+H2O
TiO2+H2O
b.部分物质的性质∶
TiCl4 | SiCl4 | FeCl3 | TiO2 | |
沸点/°C | 136.4 | 57.6 | 315 | / |
其它性质 | 极易水解 | / | / | 不溶于水 |
请回答∶
(1)步骤II抽滤时选用了玻璃砂漏斗,请说明选择的理由______。
(2)步骤III为了除去浸取液中的铁元素杂质并回收FeSO47H2O。往浸取液中加入铁粉至溶液中的Fe3+完全转化,然后抽滤,滤液用冰盐水快速冷却至FeSO47H2O结晶析出,再次抽滤并洗涤。下列说法正确的是____。
A.杂质Fe3+可能是在实验过程中氧化生成的
B.再次抽滤获得的滤液中的溶质是TiOSO4和FeSO4
C.利用冰盐水快速冷却有利于形成较大的晶体颗粒
D.再次抽滤后的洗涤应选用蒸馏水进行多次洗涤
(3)步骤IV包括钛盐的水解、产物的分离和物质的转化。操作步骤如下∶取一部分步骤III获得的滤液→(________)→(________)→(________)→(_________)→抽滤得偏钛酸(H2TiO3),将偏钛酸在坩埚中加热得到二氧化钛(TiO2)。
①将下列操作按合理顺序填入以上空格。
a.静置沉降后,用倾析法除去上层水;
b.逐滴加入到沸水中并不停搅拌,继续煮沸约10 min;
c.用热的稀硫酸洗涤沉淀2~3次,然后用热水洗涤沉淀;
d.慢慢加入其余全部滤液,继续煮沸约30 min (过程中适当补充水至原体积);
②写出操作c中用热水洗涤沉淀的具体过程_____。
(4)①另一种生产TiCl4的方法是用天然TiO2晶体为原料,利用步骤V的反应原理获得TiCl4.。产品中含有SiCl4、FeCl3等杂质,可通过精馏的方法获得高纯TiCl4,以下说法正确的是______。

A.收集TiCl4时,仪器a中的温度应控制为136.4°C
B. b处温度计的水银球的上沿和支管口的下沿齐平
C.精馏结束时留在圆底烧瓶中的主要成分是FeCl3和Si
D.装置c中的冷凝水应该“下口进、上口出”
E.可以用水浴加热的方法精馏获得TiCl4
②d处装有碱石灰的干燥管,作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了对锂离子电池研发作出卓越贡献的三位科学家。南开大学李福军研究团队以C3N4作为Li-O2可充电电池的光电极,提升了电池的能量效率,其充电工作原理如图所示。下列说法不正确的是( )
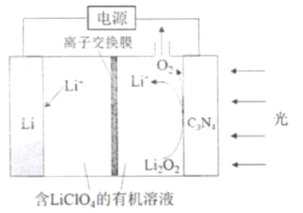
A.离子交换膜为阳离子交换膜
B.放电时,Li+移向Li电极
C.放电时,Li电极为负极,发生氧化反应
D.充电时,光电极的电极反应式为∶ Li2O2-2e-= 2Li++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O![]() )或-1g[c(H+)/c(HC2O
)或-1g[c(H+)/c(HC2O![]() )]和-lgc(C2O
)]和-lgc(C2O![]() )关系如图所示,下列说法错误的是
)关系如图所示,下列说法错误的是
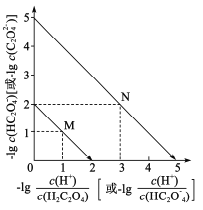
A.曲线M表示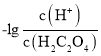 和
和![]() 的关系
的关系
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O![]() )>0
)>0
C.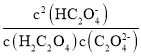 随pH的升高而减小
随pH的升高而减小
D.在NaHC2O4溶液中c(Na+)>(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(H2C2O4)
)>c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com