
【题目】钛合金在国防、医用器材领域有重要应用,某研究小组利用钛铁矿[主要成分偏钛酸亚铁(FeTiO3),含SiO2、FeO 杂质]制取TiCl4,然后进一步制备金属钛,流程如下∶

已知∶
a.发生的主要反应方程式如下∶
FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O TiOSO4+2H2O
TiOSO4+FeSO4+2H2O TiOSO4+2H2O![]() H2TiO3↓+H2SO4
H2TiO3↓+H2SO4
H2TiO3![]() TiO2+H2O
TiO2+H2O
b.部分物质的性质∶
TiCl4 | SiCl4 | FeCl3 | TiO2 | |
沸点/°C | 136.4 | 57.6 | 315 | / |
其它性质 | 极易水解 | / | / | 不溶于水 |
请回答∶
(1)步骤II抽滤时选用了玻璃砂漏斗,请说明选择的理由______。
(2)步骤III为了除去浸取液中的铁元素杂质并回收FeSO47H2O。往浸取液中加入铁粉至溶液中的Fe3+完全转化,然后抽滤,滤液用冰盐水快速冷却至FeSO47H2O结晶析出,再次抽滤并洗涤。下列说法正确的是____。
A.杂质Fe3+可能是在实验过程中氧化生成的
B.再次抽滤获得的滤液中的溶质是TiOSO4和FeSO4
C.利用冰盐水快速冷却有利于形成较大的晶体颗粒
D.再次抽滤后的洗涤应选用蒸馏水进行多次洗涤
(3)步骤IV包括钛盐的水解、产物的分离和物质的转化。操作步骤如下∶取一部分步骤III获得的滤液→(________)→(________)→(________)→(_________)→抽滤得偏钛酸(H2TiO3),将偏钛酸在坩埚中加热得到二氧化钛(TiO2)。
①将下列操作按合理顺序填入以上空格。
a.静置沉降后,用倾析法除去上层水;
b.逐滴加入到沸水中并不停搅拌,继续煮沸约10 min;
c.用热的稀硫酸洗涤沉淀2~3次,然后用热水洗涤沉淀;
d.慢慢加入其余全部滤液,继续煮沸约30 min (过程中适当补充水至原体积);
②写出操作c中用热水洗涤沉淀的具体过程_____。
(4)①另一种生产TiCl4的方法是用天然TiO2晶体为原料,利用步骤V的反应原理获得TiCl4.。产品中含有SiCl4、FeCl3等杂质,可通过精馏的方法获得高纯TiCl4,以下说法正确的是______。

A.收集TiCl4时,仪器a中的温度应控制为136.4°C
B. b处温度计的水银球的上沿和支管口的下沿齐平
C.精馏结束时留在圆底烧瓶中的主要成分是FeCl3和Si
D.装置c中的冷凝水应该“下口进、上口出”
E.可以用水浴加热的方法精馏获得TiCl4
②d处装有碱石灰的干燥管,作用是________。
【答案】强酸性溶液会腐蚀滤纸 AB b d a c 向烧杯中注入热水,充分搅拌后使固体沉降,用倾析法将清液倒出,重复2~3次直至洗净。 BD 防止空气中的水蒸气进入装置。
【解析】
钛铁矿与浓硫酸加热条件下发生反应生成TiOSO4、FeSO4,发生反应为:FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O,用多次抽滤的方法将不溶于酸的杂质除去,抽滤过程中加入铁粉为保证Fe3+完全转化为Fe2+,滤液为TiOSO4和硫酸亚铁,加热条件下可使TiOSO4水解生成H2TiO3固体和硫酸,发生反应为:TiOSO4+2H2O
TiOSO4+FeSO4+2H2O,用多次抽滤的方法将不溶于酸的杂质除去,抽滤过程中加入铁粉为保证Fe3+完全转化为Fe2+,滤液为TiOSO4和硫酸亚铁,加热条件下可使TiOSO4水解生成H2TiO3固体和硫酸,发生反应为:TiOSO4+2H2O![]() H2TiO3↓+H2SO4,得到的H2TiO3沉淀经过滤并洗涤、干燥、煅烧得到TiO2,TiO2与C、Cl2反应得到TiCl4,据此分析解答。
H2TiO3↓+H2SO4,得到的H2TiO3沉淀经过滤并洗涤、干燥、煅烧得到TiO2,TiO2与C、Cl2反应得到TiCl4,据此分析解答。
(1)钛铁矿石酸溶过程中使用的是浓硫酸,浓硫酸具有强酸性,会腐蚀滤纸,则步骤II抽滤时选用了玻璃砂漏斗;
(2)A.钛铁矿主要成分为偏钛酸亚铁(FeTiO3),含SiO2、FeO杂质,铁元素都是以+2价形式存在,酸浸时发生反应为:FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O,使用浓硫酸具有强氧化性,可使钛铁矿石中的二价铁氧化为三价铁,则杂质Fe3+是在实验过程中氧化生成的,故A正确;
TiOSO4+FeSO4+2H2O,使用浓硫酸具有强氧化性,可使钛铁矿石中的二价铁氧化为三价铁,则杂质Fe3+是在实验过程中氧化生成的,故A正确;
B.根据分析,再次抽滤过程中加入了铁粉,铁粉可将滤液中的三价铁还原为二价铁,则获得的滤液中的溶质是TiOSO4和FeSO4
C.利用冰盐水快速冷却的目的是降低FeSO47H2O的溶解度,使其从溶液中分离出来,故C错误;
D.为减少FeSO47H2O的溶解,再次抽滤后的洗涤应选用冰水进行多次洗涤,故D错误;
答案选AB。
(3)步骤IV包括钛盐的水解、产物的分离和物质的转化,主要目的是获得偏钛酸,将偏钛酸在坩埚中加热得到二氧化钛(TiO2)。操作步骤为∶取一部分步骤III获得的滤液,逐滴加入到沸水中并不停搅拌,继续煮沸约10 min,慢慢加入其余全部滤液,继续煮沸约30 min (过程中适当补充水至原体积),静置沉降后,用倾析法除去上层水,用热的稀硫酸洗涤沉淀2~3次,然后用热水洗涤沉淀,经过抽滤得偏钛酸(H2TiO3),将偏钛酸在坩埚中加热得到二氧化钛(TiO2),则操作顺序为b、d、a、c;
②操作c中用热水洗涤沉淀的具体过程为:向烧杯中注入热水,充分搅拌后使固体沉降,用倾析法将清液倒出,重复2~3次直至洗净;
(4)①A.根据表格数据可知,SiCl4、FeCl3等杂质的沸点分别为57.6°C 、315°C,TiCl4的沸点为136.4°C,收集TiCl4时,仪器a中的温度应控制为低于315°C即可,故A错误;
B. b处温度计测量的是蒸馏出来的蒸汽的温度,则水银球的上沿和支管口的下沿平齐才能较为准确的测定蒸汽温度,控制蒸馏的温度,故B正确;
C.根据A选项分析可知,精馏结束时留在圆底烧瓶中的主要成分是FeCl3和SiCl4
D.冷凝水的方向应与蒸汽的流动方向相反,则装置c中的冷凝水应该“下口进、上口出”,故D正确;
E.TiCl4的沸点为136.4°C,用水浴加热的方法,温度最高为100度,达不到TiCl4的沸点,不能精馏获得TiCl4,故E错误;
答案选BD;
②根据题给信息,TiCl4极易水解,d处装有碱石灰的干燥管,作用是防止空气中的水蒸气进入装置,避免精馏获得TiCl4发生水解。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成药物氨鲁米特。
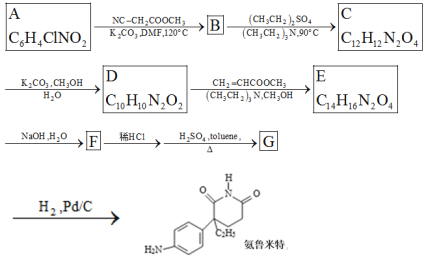
①A到B为取代反应,B的化学式为C10H8N2O4,B到C是乙基化反应。
②C到D的反应包括水解、脱去羧基(CO2 )两步反应。
③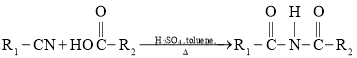
请回答:
(1)化合物A的结构简式________。
(2)下列说法不正确的是________。
A.化合物B能发生加成反应 B.化合物C能发生消去反应 C.化合物G具有碱性且在酸性条件下能水解生成CO2 D.氨鲁米特的分子式是C13H16N2O2
(3)设计化合物A转变为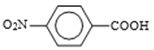 的合成路线(用流程图表示,试剂任选)________。
的合成路线(用流程图表示,试剂任选)________。
(4)写出E→F的化学方程式________。
(5)写出化合物D可能的同分异构体的结构简式________,须同时符合:①1H-NMR谱表明分子中有4种氢原子,IR谱显示仅有苯环无其他环状结构,含氨基-NH2;②该物质能水解,且能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的二氧化硫气体和二氧化碳气体相比较,下列叙述正确的是( )
A. 体积比1∶1B. 体积比11∶16
C. 分子个数比1∶1D. 密度比11∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5 g水中溶解12.5 g CuSO45H2O,恰好达到饱和,该溶液密度为1.18 g·cm-3,求:
(1)该溶液中阴阳离子的总物质的量._________________
(2)该溶液中CuSO4的物质的量浓度(保留二位小数)。________________
(3)取出20.0 mL该溶液,加入足量Ba(OH)2溶液,反应后可得到沉淀质量多少克?(保留一位小数)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) ![]() 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.1mol B和1mol CB.2mol A、3mol B和1mol He(He不参加反应)
C.2mol CD.2mol A、3mol B和3mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于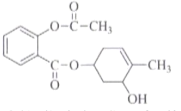 的说法,不正确的是
的说法,不正确的是
A.该物质能发生加成、氧化、聚合等反应
B.该物质苯环上的一氯取代有4种同分异构体
C.该物质在酸性条件下水解产物之一可用于合成阿司匹林
D.1mol该物质与足量NaOH溶液反应,最多可消耗5molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,已知∶CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g),下列说法不正确的是( )
CO2(g)+3H2(g),下列说法不正确的是( )
A.0.1 mol CH3OH中含共价键数为0.5NA
B.10.0g 质量分数为32%的CH3OH溶液与4.6g的钠反应,产生H2分子数为0.1NA
C.1 mol CH3OH与足量的H2O反应,得到CO2分子数为NA
D.每消耗0.1 mol CH3OH时,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硝酸钠(NaNO4)能与水发生反应∶NaNO4+H2O= NaNO3+H2O2,下列说法不正确的是( )
A.过硝酸钠可用于杀菌消毒
B.过硝酸钠中含有-O-O-结构
C.过硝酸钠具有强氧化性,没有还原性
D.将过硝酸钠加入酸性FeSO4溶液中发生的离子方程式∶![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图实验。
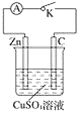
(1)打开K,观察到的现象为________________。
(2)关闭K,观察到的现象是_________。此电池的负极的电极反应式为_____。
(3)关闭K,溶液中阳离子向_______(填“Zn”或“C”)极移动,外电路中,电子流动方向是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com