
【题目】某过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。装置气密性良好。

已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学选用的装置_________(填序号)是没有必要的。实验中甲同学称取固体样品质量为a g,测得气体体积为V L,实验条件下的气体摩尔体积为Vm(L/mol),则Na2CO4的质量分数为______(用含a、V、Vm的代数式表示)。
(2)乙同学想通过实验测得的数据是_______。按他测得的数据计算出的实验结果有可能偏低,原因是________________。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用。按从左到右排列)_____________(填序号)。
【答案】③ ![]() 生成的二氧化碳的质量 CO2没有被装置②全部吸收 ⑩①③②⑨(或⑩①③⑨②)
生成的二氧化碳的质量 CO2没有被装置②全部吸收 ⑩①③②⑨(或⑩①③⑨②)
【解析】
(1)根据甲的实验原理可知,甲是想通过测量排出的水的体积来计算生成的氧气体积,进而来计算样品的纯度的,所以将氧气干燥是多余的。
答案选③;
实验中甲同学称取固体样品质量为a g,测得气体体积为V L,实验条件下的气体摩尔体积为Vm(L/mol),则为氧气的总物质的量n(O2)=![]() mol,根据反应方程式2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O、2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,
mol,根据反应方程式2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O、2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,
假设氧气全由反应2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O所得,则Na2CO4的质量为![]() g,但还发生反应2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,则其中Na2O2的质量为
g,但还发生反应2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,则其中Na2O2的质量为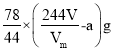 ,则Na2CO4的质量分数为
,则Na2CO4的质量分数为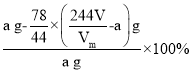 =
=![]() ;
;
(2)由乙的实验原理可知,乙是通过测量生成的二氧化碳的质量来测定其纯度的。如果反应中生成的CO2没有被装置②全部吸收,有可能使测定的结果偏低;
(3)要使结果更准确,就必须使反应中生成的二氧化碳完全被碱石灰吸收,而且还需要保证空气中的水和二氧化碳不参与反应,所以正确的顺序是⑩①③②⑨(或⑩①③⑨②)。


科目:高中化学 来源: 题型:
【题目】金属钛(Ti)具有硬度大、熔点高、耐酸碱腐蚀的优点,被广泛用于航空航天、医疗卫生及日常生活中。以钛铁矿(主要成分为FeTiO3)为主要原料冶炼金属钛的生产工艺如图所示。

回答下列有关问题:
(1)钛铁矿(精矿)中加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,且反应前后Fe的化合价不变,则FeTiO3中Ti的化合价为____。
(2)上述流程图中加入“铁屑”的目的是___(填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应
C.防止Fe2+水解 D.防止Fe3+水解
(3)溶液Ⅰ经“操作a”可得固体副产品甲,则操作a的名称为_______,副产品甲的化学式是_____。
(4)已知钛酸难溶于水,其化学式为H2TiO3。则溶液Ⅱ中加入水,加热时发生的化学方程式为_____。
(5)“操作b”为加热,则中间产品乙的化学式为______。
(6)一定条件下,利用气体丙与氢气可合成甲醇,该合成反应的化学方程式为____________,甲醇的电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(2)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO.反应如下:Ca3(PO4)2+SiO2+C![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(1)配平该反应方程式,并标出电子转移方向和数目____________.
_____Ca3(PO4)2+_____SiO2+_____C![]() _____CaSiO3+_____P4↑+_____CO↑
_____CaSiO3+_____P4↑+_____CO↑
(2)该反应中被还原的元素是_____,氧化产物是_____.
(3)每消耗24.0g碳时,有_____个电子发生转移,生成P4_____g.
(4)反应所得混合气体,折算成标况下,其气体密度为_____g/L(保留两位小数).与该反应中涉及到的磷元素相同主族的氮元素,是造成水体富营养化的主要原因.若某污水中NH4Cl含量为180mg/L.
(5)写出NH4Cl的电子式_____.
(6)为除去废水中的NH4+,向103L该污水中加入0.1mol/LNaOH溶液,发生如下反应:NH4++OH﹣→NH3+H2O.则理论上需要NaOH溶液的体积为_____L(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质的分离或提纯,应选用下述方法的哪一种?(用编号填空)
A.分液 B.过滤 C.萃取 D.蒸馏 E.结晶 F.加热分解
①除去Ca(OH)2溶液中悬浮的CaCO3____;
②从碘水中提取碘____;
③从硝酸钾和氯化钠的混合溶液中获得硝酸钾_____;
④分离植物油和水_____;
⑤分离CCl4(沸点76.75℃)和甲苯(沸点110.6℃)______。
(2)掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。

①写出下列实验仪器的名称a_____;b_____;c______;e______。
②若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有_____,将仪器补充完整后进行的实验操作的名称为____;冷凝管的进水口是____;(填f或g);
③现需配制250mL0.2mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
硼元素对植物生长及人体健康有着十分重要的作用,硼的化合物被广泛应用于新材料制备、生活生产等诸多领域。
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
A.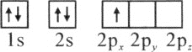
B.
C.
D.
(2)晶体硼单质能自发呈现出正二十面体的多面体外形,这种性质称为晶体的________。
(3)硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。
①H3BO3晶体中单元结构如图Ⅰ所示。各单元中的氧原子通过________氢键(用“A—B…C”表示,A、B、C表示原子)连结成层状结构,其片层结构如图Ⅱ所示,层与层之间以________(填作用力名称)相结合构成整个硼酸晶体。

②硼氢化钠中![]() 的键角大小是________,立体构型为________。
的键角大小是________,立体构型为________。
③根据上述结构判断下列说法正确的是________
a.H3BO3分子的稳定性与氢键有关
b.硼酸晶体有滑腻感,可作润滑剂
c.H3BO3分子中硼原子最外层为8e-稳定结构
d.含1mol H3BO3的晶体中有3 mol氢键
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是________;已知晶胞边长为a pm,则磷化硼晶体的密度是________g·cm-3(列出含a、NA的计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大。
②E元素的电离能数据见下表(kJ·mol-1):

③B与F同主族。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤B,C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A,B、D、E四种元素的两种无水盐的化学式__________、__________。
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
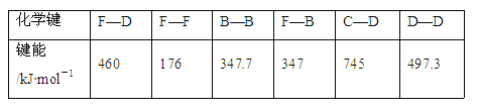
试计算1 mol F单质晶体燃烧时的反应热ΔH______(要写单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com