
【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ![]()
![]() +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前20 min的平均速率为v(H2)=0.004molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08molL﹣1 , 则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 达到平衡前v(正)>v(逆)
【答案】C
【解析】解:A.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol﹣0.24mol=0.16mol,故v(乙苯)= ![]() =0.004molL﹣1min﹣1 , 速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004molL﹣1min﹣1 , 故A正确;
=0.004molL﹣1min﹣1 , 速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004molL﹣1min﹣1 , 故A正确;
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为 ![]() =0.1mol/L,升高温度乙苯的浓度变为0.08molL﹣1 , 说明平衡向正反应移动,正反应为吸热反应,故a>0,故B错误;
=0.1mol/L,升高温度乙苯的浓度变为0.08molL﹣1 , 说明平衡向正反应移动,正反应为吸热反应,故a>0,故B错误;
C.由表中数据可知,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,达平衡时乙苯的转化率为 ![]() ×100%=50%,保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,反应混合物的浓度不变,平衡不移动,乙苯的转化率不变为50%,故C正确;
×100%=50%,保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,反应混合物的浓度不变,平衡不移动,乙苯的转化率不变为50%,故C正确;
D.30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,平衡时苯乙烯的浓度为 ![]() =0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数k=
=0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数k= ![]() =0.1,相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 此时浓度商Qc=
=0.1,相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 此时浓度商Qc= ![]() =0.15>K=0.1,反应向逆反应进行,故达到平衡前v正<v逆 , 故D错误;
=0.15>K=0.1,反应向逆反应进行,故达到平衡前v正<v逆 , 故D错误;
故选:AC.
【考点精析】关于本题考查的化学平衡状态本质及特征和化学平衡的计算,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.硝酸钾溶液能导电,所以硝酸钾溶液是电解质
B.石墨有较好的导电性,所以石墨属于电解质
C.液态氯化氢、固态氯化钠均不能导电,所以氯化氢、氯化钠均不是电解质
D.蔗糖在水溶液中和熔融状态下均不能导电,所以蔗糖是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下: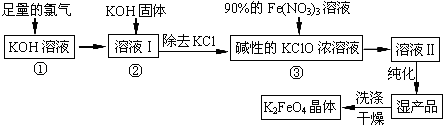
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3 . 写出在温度较高时KOH 与Cl2反应的化学方程式 , 该反应的氧化产物是 .
(2)在溶液Ⅰ中加入KOH固体的目的是(填编号).
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 .
(4)如何判断K2FeO4晶体已经洗涤干净 .
(5)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.FeO42﹣在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是(填字母). 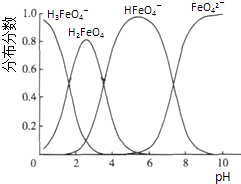
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4﹣的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH﹣═HFeO4﹣+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法不正确的是
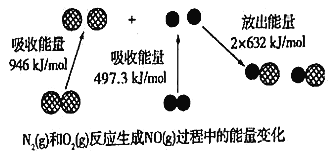
A. 通常情况下,N2比NO稳定
B. “雷雨发庄稼”中涉及到N2(g)和O2(g)的反应
C. 1mol N2(g)和1mol O2(g)反应吸收的能量为179.3kJ
D. NO是酸性氧化物,可直接用氢氧化钠溶液吸收而除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol纯净的A置于真空密闭容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其分解达到平衡:A(s)![]() 2B(g) +C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g) +C(g),下列可以判断该反应已达到化学平衡状态的是
A. 反应速率:vB(正)=vc(逆) B. B的体积分数不变
C. 气体的密度保持不变 D. 混合气体的平均摩尔质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~H 均为短周期元素、请回答下列问题:
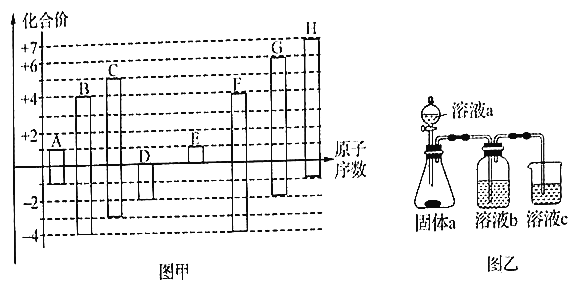
(1)F元素在周期表中的位置为________,A 和D形成的既有极性键又有非极性键的化合物,其电子式为________ 。
(2)D、E、G、H 的简单离子半径由大到小的顺序为(写化学式) ________ 。
(3)用电子式表示出E、H 两种元素组成的化合物的形成过程________ 。
(4)用乙图装置证明酸性:HCl>H2CO3>H2SiO3,则溶液b为________;溶液c中的离子方程式为________。下列事实可用于比较元素碳与Cl 非金属性相对强弱的是________。
a.最高正化合价Cl>C
b.C1的氢化物比C 的简单氢化物稳定
C.C1的氢化物比C 的简单氢化物沸点高
d.最高价氧化物的水化物的酸性:HC1O4>H2CO3
(5)A和D形成为18电子分子与A和G形成的13电了分子按4 :1的个数比反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,M、N 两种气体的物质的量随时间变化的曲线如图所示:

(1)反应的化学方程式为_______________。
(2)反应达到最大限度的时间是______min,该时间内的平均反应速率v(N)=______。
(3)反应达到平衡状态时,放中6QkJ的热量,当容器中充入lmolN,反应放出的热量为_____。
①等于QkJ ②小于QkJ ③大于QkJ ④等于2QkJ
(4)判断该反应达到平衡状态的依据是__________。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的密度不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2molN的同时,生成1molM
(5)能能加快反应速率的措施是_________。
①升高温度 ②容器体积不变,充入隋性气体Ar
③容器压強不变,充入惰性气体Ar ④使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2 ![]() 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( ) ①单位时间内生成n mol O2的同时生成2n mol NO2
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( ) ①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态.
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的锌与100mL 18.5mol/L H2SO4充分反应后,锌完全溶解,同时生成气体A 22.4L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物
B.反应中共消耗Zn 65g
C.气体A中SO2和H2的体积比为1:4
D.反应中共转移电子2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com