
【题目】下列化学实验操作或事故处理方法不正确的是( )
A. 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
B. 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸
C. 酒精灯着火时可用湿抹布扑灭
D. 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】按要求完成下列空白:
⑴印刷电路板是由高分子材料和铜箔复合而成.刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的离子方程式 。
⑵请写出在碱性溶液中,ClO![]() 与Fe2+反应的离子方程式为: 。
与Fe2+反应的离子方程式为: 。
⑶NaAlH4是重要的还原剂。请写出NaAlH4与水发生氧化还原反应的化学方程式: 。
⑷+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,请写出该反应的离子方程式: 。
⑸亚氯酸钠(NaClO2)溶液可作为烟气的吸收剂,并对烟气进行脱硫、脱硝。在装有亚氯酸钠溶液的鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO | SO | NO | NO | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
写出NaClO2溶液脱硝过程中主要反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应方程式是化学学习的基本工具,本期在化学反应与化学平衡章节学过几个重要的化学方程式,请你按要求写出:
(1)硫代硫酸钠与稀硫酸溶液反应的离子方程式:
(2)碘化钾的稀硫酸溶液与空气中氧气反应的离子方程式:
(3)在重铬酸钾的硫酸溶液中的Cr2O72—与CrO42—之间转化的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学反应可用下式表示:A + B →C + D +H2O请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:________________。
(2)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,则A与B的组合是:______________或______________。
(3)若A为MnO2,B为盐酸,C是黄绿色的单质气体,写出该反应的离子方程式___________________。
(4)若A为单质,B为硝酸,请写出符合上式的化学方程式__________________。
(5)若C、D均为气体且都能使澄清石灰水变浑浊,且D可以使品红褪色,则A与B反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:
NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4kJ·mol-1
1/2N2(g)+CO2(g) ΔH=-373.4kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
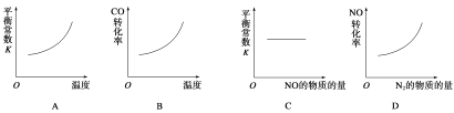
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g)△H=-15.73kJ/mol
CO2(g)△H=-15.73kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究碳素钢的性质,用铁钉(碳素钢)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______________________。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用_______(选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为________。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1 和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。

(3)装置B中试剂的作用是______________________。
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于________(填序号)。
A.A之前 B.A—B间 C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要480ml 0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取12.5g胆矾配成500mL溶液 B.称取8.0g胆矾配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水 D.称取7.68g硫酸铜,加入500mL水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度下,Kw = 10-12。
(1)若保持温度不变,向少量水中加入_________g的NaOH固体,并加水至1 L,才能使溶液中水电离产生的H+、OH-的浓度乘积即:c(H+)·c(OH-) = 10-22
(2)若保持温度不变,某溶液中c(H+)为1×10-7 mol/L,则该溶液显________性(选填“酸”、“碱”或“中”)。
II.(3)实验室中常用NaOH进行洗气和提纯,当600 mL 1 mol/L NaOH溶液吸收标准状况下8.96 L CO2气体时所得溶液中各离子浓度由大到小的顺序是 。
(4)已知常温下Kw[Fe(OH)3] = 4.0×10-38,在FeCl3溶液中加入NaHCO3溶液,发生反应的离子方程式为_____________。若所得悬浊液的pH调整为4,则溶液中Fe3+的浓度为__________mol/L。
(5)试利用平衡移动原理解释下列事实:FeS不溶于水,但能溶于稀盐酸中_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com