
����Ŀ��I��ij�¶��£�Kw = 10��12��
��1���������¶Ȳ��䣬������ˮ�м���_________g��NaOH���壬����ˮ��1 L������ʹ��Һ��ˮ���������H+��OH����Ũ�ȳ˻�����c(H+)��c(OH��) = 10��22
��2���������¶Ȳ��䣬ij��Һ��c(H+)Ϊ1��10��7 mol/L�������Һ��________�ԣ�ѡ����������������������������
II����3��ʵ�����г���NaOH����ϴ�����ᴿ����600 mL 1 mol/L NaOH��Һ���ձ�״����8.96 L CO2����ʱ������Һ�и�����Ũ���ɴ�С��˳���� ��
��4����֪������Kw[Fe(OH)3] = 4.0��10��38����FeCl3��Һ�м���NaHCO3��Һ��������Ӧ�����ӷ���ʽΪ_____________������������Һ��pH����Ϊ4������Һ��Fe3+��Ũ��Ϊ__________mol/L��
��5��������ƽ���ƶ�ԭ������������ʵ��FeS������ˮ����������ϡ������_________________��
���𰸡�I����1��4��2����
II����3��c(Na+)>c(HCO3��)>c(CO32��)>c(OH��)>c(H+)
��4��Fe3++3HCO3��=Fe(OH)3��+3CO2�� 4.0��10��8
��5��FeS(s)![]() Fe2+(aq)+S2��(aq)������ϡ�������S2��+2H+=H2S�����ƻ���FeS���ܽ�ƽ����ʹ����ƽ����FeS�ܽ�ķ����ƶ�����FeS�ܽ⡣
Fe2+(aq)+S2��(aq)������ϡ�������S2��+2H+=H2S�����ƻ���FeS���ܽ�ƽ����ʹ����ƽ����FeS�ܽ�ķ����ƶ�����FeS�ܽ⡣
��������
�����������1����ˮ�ĵ��뷽��ʽ��֪��ˮ�������c(H+)����ˮ�������c(OH��)�� �ɵ��������H+��OH����Ũ�ȳ˻� = c(H+)��c(OH��) = 10��22��֪��ˮ�������c(H+) = ˮ�������c(OH��) = 1��10��11 mol/L������NaOH��ǿ�������H2O�Ǽ�������������NaOH�������c(OH��) = c(NaOH) >>ˮ�������c(OH��)������Һ�е�c(OH��) ���Ƶ��� c(NaOH)������Һ����c(H+) = ˮ�������c(H+)����Kw = 10��12 = c(H+)��c(OH��)��c(OH��) = 1��10��1 mol/L����c(NaOH) = 1��10��1 mol/L = 0.1 mol/L����![]() ��ϡ��Һ�����Լ����ˮ�������
��ϡ��Һ�����Լ����ˮ�������![]() ��֪�� c(NaOH) = 0.1 mol/L =
��֪�� c(NaOH) = 0.1 mol/L =  ����m = 4 g����2���������¶Ȳ�����ij��Һ��c(H+)Ϊ1��10��7 mol/L����Kw = 10��12 = c(H+)��c(OH��)��֪��c(OH��) = 1��10��5 mol/L��1��10��5 > 1��10��7������Һ�е�c(H+)С��c(OH��)����˸���Һ�Լ�������3������cV��
����m = 4 g����2���������¶Ȳ�����ij��Һ��c(H+)Ϊ1��10��7 mol/L����Kw = 10��12 = c(H+)��c(OH��)��֪��c(OH��) = 1��10��5 mol/L��1��10��5 > 1��10��7������Һ�е�c(H+)С��c(OH��)����˸���Һ�Լ�������3������cV��![]() ��֪��NaOH��CO2��n�ֱ�Ϊ0.6 mol��0.4mol����NaOH��ϵ��Ϊ6�����⡢ԭ�Ӹ����غ���ƽ�ɵ���6 NaOH + 4 CO2 = 2 Na2CO3 + 2 NaHCO3 + 2 H2O��˵��������Һ��Na2CO3�� NaHCO3��Ũ���������ԼΪ0.33mol/L���������ʶ���ǿ����ʡ�ǿ�������������c(Na+)���������������H2CO3 > HCO3������˶��߶�Ӧ����NaHCO3��Na2CO3����ˮ��̶���HCO3�� < CO32������˴ﵽƽ��ʱ��Һʣ���� c(HCO3��) > c(CO32��)������ˮ��̶Ƚ��������ˮ�����ɵ�c(OH��) < c(CO32��)��ǿ��������ˮ�������ˮ�������������������Һ�������������ƽ��ʱ��Һ��c(H+)��С����4��FeCl3��ǿ����������NaHCO3��ǿ���������������ܷ���˫ˮ�ⷴӦ�������������������Ͷ�����̼����������1����ƽ�ɵ���Fe3+ + 3 HCO3�� = Fe(OH)3�� + 3 CO2��������������Һ��pH����Ϊ4�������Һ�е�c(H+) = 1��10��4 mol/L����������Kw = 10��14 = c(H+)��c(OH��)��c(OH��) = 1��10��10 mol/L����Fe(OH)3
��֪��NaOH��CO2��n�ֱ�Ϊ0.6 mol��0.4mol����NaOH��ϵ��Ϊ6�����⡢ԭ�Ӹ����غ���ƽ�ɵ���6 NaOH + 4 CO2 = 2 Na2CO3 + 2 NaHCO3 + 2 H2O��˵��������Һ��Na2CO3�� NaHCO3��Ũ���������ԼΪ0.33mol/L���������ʶ���ǿ����ʡ�ǿ�������������c(Na+)���������������H2CO3 > HCO3������˶��߶�Ӧ����NaHCO3��Na2CO3����ˮ��̶���HCO3�� < CO32������˴ﵽƽ��ʱ��Һʣ���� c(HCO3��) > c(CO32��)������ˮ��̶Ƚ��������ˮ�����ɵ�c(OH��) < c(CO32��)��ǿ��������ˮ�������ˮ�������������������Һ�������������ƽ��ʱ��Һ��c(H+)��С����4��FeCl3��ǿ����������NaHCO3��ǿ���������������ܷ���˫ˮ�ⷴӦ�������������������Ͷ�����̼����������1����ƽ�ɵ���Fe3+ + 3 HCO3�� = Fe(OH)3�� + 3 CO2��������������Һ��pH����Ϊ4�������Һ�е�c(H+) = 1��10��4 mol/L����������Kw = 10��14 = c(H+)��c(OH��)��c(OH��) = 1��10��10 mol/L����Fe(OH)3 ![]() Fe3+ + 3OH����֪��Kw[Fe(OH)3] = 4.0��10��38 = c(Fe3+) c3(OH��)����c(Fe3+) =
Fe3+ + 3OH����֪��Kw[Fe(OH)3] = 4.0��10��38 = c(Fe3+) c3(OH��)����c(Fe3+) = ![]() mol/L = 4.0��10��8 mol/L����5��FeS(s)
mol/L = 4.0��10��8 mol/L����5��FeS(s)![]() Fe2+(aq) + S2��(aq)������ϡ�������S2�� + 2 H+ = H2S�����ƻ���FeS���ܽ�ƽ����ʹ����ƽ����FeS�ܽ�ķ����ƶ�����FeS������ˮ����������������
Fe2+(aq) + S2��(aq)������ϡ�������S2�� + 2 H+ = H2S�����ƻ���FeS���ܽ�ƽ����ʹ����ƽ����FeS�ܽ�ķ����ƶ�����FeS������ˮ����������������


 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʵ��������¹ʴ�����������ȷ���ǣ� ��
A. �������ὦ�����У�Ӧ������ˮ��ϴ����ϴ��գ�۾�
B. ������Ũ����Һմ��Ƥ���ϣ�Ҫ�����ô���ˮ��ϴ��Ȼ��Ϳ������
C. �ƾ����Ż�ʱ����ʪĨ������
D. ����������Һʱ����������Ͳ�м���һ�������ˮ�����ڽ�����������������Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݡ��ο���Ϣ���������п�ѧ�����������21���͵���Դ������δ����ʯ�����Ĺ۵㡣
��1���������������ȼ�յ��Ȼ�ѧ����ʽΪSi��s��+ O2��g���T SiO2��s�� ��H = ��989.2 kJmol��1���йؼ����������±���
��ѧ�� | Si-O | O�TO | Si-Si |
���� / kJmol��1 | x | 498.8 | 176 |
��֪1 mol Si�к�2 mol Si-Si����1 mol SiO2�к�4 mol Si-O������x��ֵΪ__________��
��2���������Ϊһ���ձ�ʹ�õ�������Դ���������ã��������������ص�����˵���У�����Ϊ��������______________��
A����������䡢���棬�Ӱ�ȫ�Ƕȿ��ǣ�������ѵ�ȼ��
B�������Դ�ḻ�����ڿ��ɣ��ҿ�����
C����ȼ�շų�����������ȼ�ղ���Ի�����Ⱦ�̶ȵͣ�������Ч����
D��Ѱ�Ҹ�Ч�´���������ʹ��ӦSiO2 + 2 C![]() Si + 2 CO ���ڳ����·������ǹ���Դ�������õĹؼ�����
Si + 2 CO ���ڳ����·������ǹ���Դ�������õĹؼ�����
��3����ҵ�Ʊ�����ķ�ӦΪ2 H2��g��+ SiCl4��g���T Si��s��+ 4 HCl��g�� ��H = + 240.4 kJmol��1�����ɵ�HClͨ��100 mL 1 molL��1��NaOH��Һǡ����ȫ���������������Ʊ��������Ӧ������__________�����������������ͷ�����������Ϊ__________kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һ���¶�ѹǿ����N2(g) + 3H2(g)![]() 2 NH3(g) ��H = ��92 kJ/mol����ͬ������ij�����ܱ���������ͨ��1.0 mol N2��3.0 mol H2����Ӧ���ʱ�ų�����Q1 kJ������һ�����ͬ�Ķ����ܱ���������ͨ��1.5 mol N2��3.0 mol H2����ͬ�����·�Ӧ���ʱ�ų�����ΪQ2 kJ�������й�ϵ��ȷ������ ��
2 NH3(g) ��H = ��92 kJ/mol����ͬ������ij�����ܱ���������ͨ��1.0 mol N2��3.0 mol H2����Ӧ���ʱ�ų�����Q1 kJ������һ�����ͬ�Ķ����ܱ���������ͨ��1.5 mol N2��3.0 mol H2����ͬ�����·�Ӧ���ʱ�ų�����ΪQ2 kJ�������й�ϵ��ȷ������ ��
A��2 Q2 = Q1 = 92.4 B��Q2 < Q1 < 92.4 C��Q1 = Q2 = 92.4 D��Q1 < Q2 < 92.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ�أ�����ͬһ���ڵ�һ����( )
A. H ��Li ��Na B. Na ��Mg ��Ca
C. Al ��P ��S D. N ��O ��Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�IJ�������������һ�����ҵ�ʯ�ͻ�����չˮƽ�����й�����ϩ��˵����ȷ����
A. �뱽��Ϊͬ���칹��
B. �����д���̼̼˫��
C. ��ʹ������Ȼ�̼��Һ��ɫ
D. ��ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л������ʽΪC4H8���ݴ��Ʋ���ṹ���������������ǣ� ��
A����������ʹ���Ը��������Һ��ɫ
B��һ�ȴ������ֻ��һ��
C�����ӽṹ�м�����Ŀ������0��1��2
D��������CH4��C4H8�ֱ�����������ȫȼ�գ�CH4�ĺ�����С��C4H8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ǵ����ӣ��������������ڱ����������ǣ� ��
A.����Դ���滯ʯ��Դ
B.�ƹ�ʹ��̫���ܵ��
C.�綯��������ȼ������
D.��ֽ����ˮֱ���ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��������25 mL 0.1 mol/L MOH��Һ����εμ�0.2 mol/L HCl��Һ��������ҺpH�ı仯���ߡ������ƶ���ȷ����
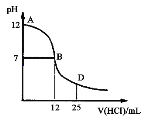
A��MOH��ˮ�еĵ��뷽��ʽ�ǣ�MOH=N����OH��
B����B���ʾ���ǡ���к�
C��A����D������Һ�ĵ�����������ǿ(��������仯)
D����D��ʱ������c(H��)��c(OH��)��c(Cl��)��c(M��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com