
����Ŀ����Ҫ��������пհף�
��ӡˢ��·�����ɸ߷��Ӳ��Ϻ�ͭ�����϶��ɣ�����ӡˢ��·ʱ��Ҫ��FeCl3��Һ��Ϊ����ʴҺ��������CuCl2��FeCl2����д����Ӧ�����ӷ���ʽ ��
����д���ڼ�����Һ�У�ClO![]() ��Fe2+��Ӧ�����ӷ���ʽΪ�� ��
��Fe2+��Ӧ�����ӷ���ʽΪ�� ��
��NaAlH4����Ҫ�Ļ�ԭ������д��NaAlH4��ˮ����������ԭ��Ӧ�Ļ�ѧ����ʽ�� ��
��+6�۸��Ļ����ﶾ�Խϴ���NaHSO3�����Է�Һ�е�Cr2O72����ԭ��Cr3+����д���÷�Ӧ�����ӷ���ʽ�� ��
����������(NaClO2)��Һ����Ϊ���������ռ���������������������������װ������������Һ�Ĺ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ5��103mol��L1����Ӧһ��ʱ�����Һ������Ũ�ȵķ���������±���
���� | SO | SO | NO | NO | Cl |
c/(mol��L1) | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ ��
���𰸡�(1)2Fe3++Cu=2Fe2++Cu2+
(2)4Fe2++ ClO![]() +8OH��+2H2O=4Fe(OH)3��+Cl����4Fe(OH)2+ ClO
+8OH��+2H2O=4Fe(OH)3��+Cl����4Fe(OH)2+ ClO![]() +2H2O=4Fe(OH)3+Cl��
+2H2O=4Fe(OH)3+Cl��
(3)NaAlH4+2H2O==NaAlO2+4H2����NaAlH4+4H2O==Na[Al(OH)4]+4H2��
(4)Cr2O![]() +3HSO
+3HSO![]() +5H+ =2Cr3++3SO
+5H+ =2Cr3++3SO![]() +4H2O
+4H2O
(5)��4NO+3ClO![]() +4OH�� = 4NO
+4OH�� = 4NO![]() +2H2O+3Cl-��4NO+3ClO
+2H2O+3Cl-��4NO+3ClO![]() +2H2O = 4NO
+2H2O = 4NO![]() +4H++3Cl��
+4H++3Cl��
��������
���������(1)��FeCl3��Һ��Ϊ����ʴҺ���ܽ�ͭ������CuCl2��FeCl2��������Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+��
���ڼ�����ҺClO![]() ����Fe2+��Ӧ�����ӷ���ʽΪ4Fe2++ ClO
����Fe2+��Ӧ�����ӷ���ʽΪ4Fe2++ ClO![]() +8OH��+2H2O=4Fe(OH)3��+Cl����4Fe(OH)2+ ClO
+8OH��+2H2O=4Fe(OH)3��+Cl����4Fe(OH)2+ ClO![]() +2H2O=4Fe(OH)3+Cl����
+2H2O=4Fe(OH)3+Cl����
��NaAlH4����Ҫ�Ļ�ԭ����NaAlH4��ˮ����������ԭ��Ӧ����������ƫ�������Ļ�ѧ����ʽΪ NaAlH4+2H2O==NaAlO2+4H2����NaAlH4+4H2O==Na[Al(OH)4]+4H2����
����NaHSO3�����Է�Һ�е�Cr2O72����ԭ��Cr3+��������Ӧ�����ӷ���ʽΪCr2O![]() +3HSO
+3HSO![]() +5H+ =2Cr3++3SO
+5H+ =2Cr3++3SO![]() +4H2O��
+4H2O��
(5)�������ƾ�������������NaClO2��Һ�ʼ�������NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽΪ3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�ã�������������ȷ������ ��

A��a��b������ʱ����Ƭ�ϻ��н���ͭ����
B��a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2++2e���TCu
C������a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ������ɫ���dz��ɫ
D��a��b����ʱ��ͭƬ�Ϸ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����ӵ�����������˵����ȷ����( )
A��17g NH3���е�����Ϊ10NA
B������£�4.48LH2O�������ķ�������0.2NA
C��0.1mol/L��K2SO4��Һ��,K+����ĿΪ0.2NA
D��30 g����(C2H6)������ԭ����ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52g ͭþ�Ͻ���ȫ�ܽ���50mL �ܶ�Ϊ1.40 g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120 mL����״��������Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54 g����������˵������ȷ���ǣ�������
A. �úϽ���ͭ��þ�����ʵ���֮����2:1
B. ��Ũ������HNO3�����ʵ���Ũ����14.0 mol/L
C. NO2��N2O4�Ļ�������У�NO2�����������80%
D. �õ�2.54 g����ʱ������NaOH��Һ�������600 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ��ȷ�NO2 ���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У��������·�Ӧ��2NO2��g�� ![]() N2O4��g�� ��H��0����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ�����NO2%�������������淴Ӧ�¶���T���仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ�����������
N2O4��g�� ��H��0����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ�����NO2%�������������淴Ӧ�¶���T���仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ�����������
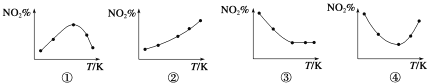
A���٢� B���٢� C���ڢ� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ�����������Һ�кʹ�����Һ������Һ��pHֵ����7�����ʱ
A������������������ʵ������ B���������������ǡ���к�
C���������ƹ��� D��������ʣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������N2H4����һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯����ͼ��ʾ����֪����1mol��ѧ�������������kJ����N��NΪ942��O��OΪ500��N��NΪ154�������1molN��H�������������kJ������ ��

A��194 B��391 C��516 D��658
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽�����е��ǣ� ��
A.��Ũ������ﰱ��
B.�÷�̪��Һ����������Һ
C.ͨ��Cl2��ȥFeCl3��Һ�е�FeCl2
D.����Fe�۳�ȥAl3+��Һ�е�����Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʵ��������¹ʴ�����������ȷ���ǣ� ��
A. �������ὦ�����У�Ӧ������ˮ��ϴ����ϴ��գ�۾�
B. ������Ũ����Һմ��Ƥ���ϣ�Ҫ�����ô���ˮ��ϴ��Ȼ��Ϳ������
C. �ƾ����Ż�ʱ����ʪĨ������
D. ����������Һʱ����������Ͳ�м���һ�������ˮ�����ڽ�����������������Ũ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com