
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
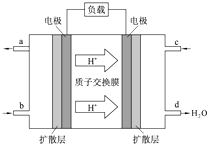 人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
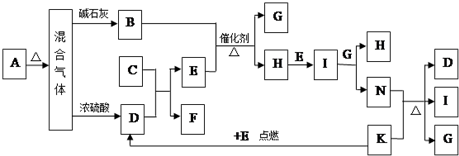
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 |
| B、丙烯能发生加成反应,还能使酸性KMnO4溶液褪色,但不能发生取代反应 |
| C、乙烷和丙烯的物质的量共1mol,完成燃烧生成3mol H2O |
| D、相同质量的甲烷和乙烷完全燃烧乙烷耗氧量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、啤酒开启后泛起大量泡沫 |
| B、实验室中常用排饱和食盐水的方法收集氯气 |
| C、将食物放在冰箱里延长保质期 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com