
【题目】为实现下列实验目的,下表提供的主要仪器以及所用试剂均合理的是( )
选项 | 实验目的 | 主要仪器 | 试剂 |
A | 配制480mL | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
B | 分离 | 分液漏斗、烧杯 | 乙醇 |
C | 鉴别 | 试管、胶头滴管 | 澄清石灰水 |
D | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】(1)①某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+I2(g)===
(g)+I2(g)===![]() (g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
(g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
②环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
(2) 298 K时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)![]() AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

下列可判断反应达到平衡状态的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.  不再变化
不再变化
d.c(I-)=y mol·L-1
(3)已知反应2HI(g) ![]() H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

A. 根据图象无法确定改变温度后平衡移动方向
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a>c+d
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) ![]() 2G(g)。平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。平衡时G的体积分数(%)随温度和压强的变化如下表所示:
温度/体积分数/压强 | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | B |
915 | c | 75.0 | D |
1000 | E | f | 83.0 |
①b<f ②915 ℃、2.0 MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1 000 ℃)>K(810 ℃) 上述①~④中正确的 ( )
A.①②B.②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用于制取、提纯并收集表格中的四种气体![]() 、b、c表示相应仪器中加入的试剂
、b、c表示相应仪器中加入的试剂![]() ,其中可行的是( )
,其中可行的是( )
选项 | 气体 | a | b | c |
|
A |
| 浓硝酸 | 铜片 | NaOH溶液 | |
B |
| 浓硫酸 | Cu | 酸性 | |
C |
| 浓氨水 | 生石灰 | 碱石灰 | |
D |
| 稀硝酸 |
| 浓硫酸 |
A.A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800°C时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g) H<0,测得n(NO)随时间的变化如下表:
2NO2(g) H<0,测得n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)NO的平衡浓度c(NO)=____________________。
(2)下图中表示NO2的变化的曲线______________。(填字母)
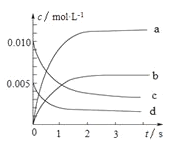
(3)能说明该反应已经达到化学平衡状态的是______________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=v正(O2) D.容器内NO、O2、NO2同时存在
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
A.及时分离出NO2气体B.适当升高温度
C.增大O2的浓度D.选择高效的催化剂
(5)下图中的曲线表示的是其它条件一定时,体系中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示v(正)<v(逆)的点是____________。(填选项)
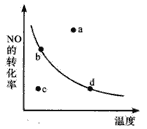
A.a B.b C.c D.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)![]() 2CO(g) △H=Q kJ/mol。图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
2CO(g) △H=Q kJ/mol。图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
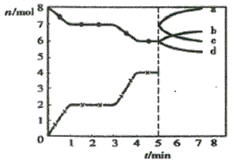
A.0~1min,v(CO)=1 mol/(L·min);1~3min时,v(CO)=v(CO2)
B.当容器内的压强不变时,反应一定达到平衡状态,且![]()
C.3min时温度由T1升高到T2,则Q>0,再达平衡时![]()
D.5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H=-1025kJ/mol。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g) △H=-1025kJ/mol。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
A.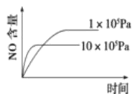 B.
B.
C.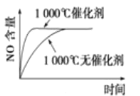 D.
D.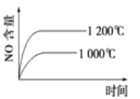
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com