
【题目】800°C时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g) H<0,测得n(NO)随时间的变化如下表:
2NO2(g) H<0,测得n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)NO的平衡浓度c(NO)=____________________。
(2)下图中表示NO2的变化的曲线______________。(填字母)
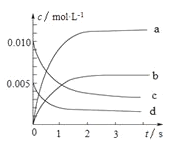
(3)能说明该反应已经达到化学平衡状态的是______________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=v正(O2) D.容器内NO、O2、NO2同时存在
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
A.及时分离出NO2气体B.适当升高温度
C.增大O2的浓度D.选择高效的催化剂
(5)下图中的曲线表示的是其它条件一定时,体系中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示v(正)<v(逆)的点是____________。(填选项)
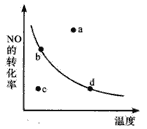
A.a B.b C.c D.d
【答案】0.035mol/L b B C A
【解析】
(1)根据平衡时浓度不变分析;
(2)结合方程式分析平衡时二氧化氮的浓度,进而确定曲线;
(3)根据平衡的判断依据进行分析;
(4)条件对反应速率和平衡的影响分析;
(5)根据反应都要到平衡分析各点的进行方向。
(1)根据表中数据分析,平衡时一氧化氮时的浓度为![]() ;
;
(2)根据方程式计算分析,二氧化氮的平衡浓度为0.065mol/L,所以b为该曲线;
(3)A.v(NO2)=2v(O2)没有说明反应的方向,不能说明反应到平衡,故A错误;
B.容器内压强保持不变可以说明反应到平衡,故B正确;
C.v逆(NO)=v正(O2) 表示正逆反应速率不相等,故C错误;
D.可逆反应中反应物和生成物同时存在,故容器内NO、O2、NO2同时存在不能说明到平衡,故D错误;
故选B。
(4)A.及时分离出NO2气体,反应速率减慢,平衡正向移动,故A错误;
B.适当升高温度,反应增大,平衡逆向移动,故B错误;
C.增大O2的浓度,反应速率增大,平衡正向移动,故C正确;
D.选择高效的催化剂,反应速率增大,但平衡不移动,故C错误;
故选C。
(5)曲线上的各点为平衡点,正逆反应速率相等,a点一氧化氮的转化率比平衡时高,说明该反应向逆向进行,即正反应速率小于逆反应速率,故正确;c点一氧化氮转化率比平衡时低,说明该反应向正向进行,正反应速率大于逆反应速率。故选A。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是

A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)![]() 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4 kJ是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现下列实验目的,下表提供的主要仪器以及所用试剂均合理的是( )
选项 | 实验目的 | 主要仪器 | 试剂 |
A | 配制480mL | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
B | 分离 | 分液漏斗、烧杯 | 乙醇 |
C | 鉴别 | 试管、胶头滴管 | 澄清石灰水 |
D | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在如下反应。2A(g)+B(g)![]() 3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是( )
3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是( )
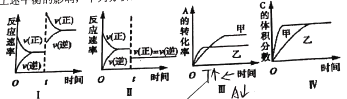
A.图Ⅰ表示增加生成物浓度对该平衡的影响
B.图Ⅱ表示增大压强对该平衡的影响
C.图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D.图Ⅳ表示催化剂对该平衡的影响,催化效率:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
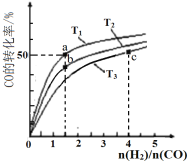
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮酸(HN3)与醋酸的酸性相似,0.2 mol HN3与0.2 mol NaOH反应后将溶液稀释至500 mL,测得溶液pH=a,下列说法一定错误的是( )
A.HN3水溶液中微粒浓度大小顺序为c(HN3)>c(H+)>c(N3—)>c(OH-)
B.题示500 mL溶液中离子浓度大小顺序为c(Na+)>c(N3—)>c(OH-)>c(H+)
C.题示500 mL溶液中由水电离产生的c(OH-)=1×10-amol·L-1
D.根据题给数据可以计算该温度下叠氮酸的电离平衡常数Ka
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在KI溶液中存在平衡:
在KI溶液中存在平衡:![]() ,某
,某![]() 、KI混合溶液中,
、KI混合溶液中,![]() 与温度T的平衡曲线图如图。下列说法不正确的是( )
与温度T的平衡曲线图如图。下列说法不正确的是( )

A.反应![]() 的
的![]()
B.若温度为![]() 、
、![]() ,反应的平衡常数分别为
,反应的平衡常数分别为![]() 、
、![]() ,则
,则![]()
C.若反应进行到状态D时,一定有![]()
D.状态A与状态B相比,状态A的![]() 小
小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
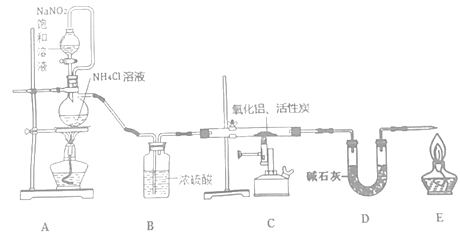
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com