
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是

A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
【答案】D
【解析】
分析特殊点,a点为硫酸和氢氧化钡恰好反应的点,导电性几乎为零,b点为氢氧化钡和硫酸氢钠反应时钡离子恰好沉淀的点,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点。
A. 根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为![]() 溶液和硫酸的反应,则曲线②为
溶液和硫酸的反应,则曲线②为![]() 溶液和硫酸氢钠溶液的反应,故A正确;
溶液和硫酸氢钠溶液的反应,故A正确;
B.根据图知,a点为![]() 溶液和硫酸恰好反应,硫酸和硫酸氢钠溶液的物质的量浓度相等,则b点为钡离子恰好沉淀,溶质为氢氧化钠,B正确;
溶液和硫酸恰好反应,硫酸和硫酸氢钠溶液的物质的量浓度相等,则b点为钡离子恰好沉淀,溶质为氢氧化钠,B正确;
C. a点为![]() 溶液和硫酸恰好反应,显中性,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点,溶液显中性,C正确;
溶液和硫酸恰好反应,显中性,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点,溶液显中性,C正确;
D.c点加入硫酸和硫酸氢钠的物质的量相等,故加入氢离子的量不相等,故氢氧根的量不相等,D错误;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
氨的制备与利用。
(1)工业合成氨的化学方程式是_______________。
氨的定量检测。水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

(2)利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________。
(3)若利用氨气传感器将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,则水样中氨氮(以氨气计)含量为_________mg·L-1。
(4)氨的转化与去除。 微生物燃料电池(MFC)是一种现代化氨氮去除技术。如图为MFC碳氮联合同时去除的氮转化系统原理示意图。

已知A、B两极生成CO2和N2的物质的量之比为5:2,写出A极的电极反应式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如右图所示,下列说法正确的是
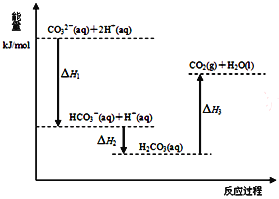
A. 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为放热反应
B. H1>H2 H2<H3
C. CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
D. H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则H3变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+I2(g)===
(g)+I2(g)===![]() (g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
(g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
②环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
(2) 298 K时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)![]() AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

下列可判断反应达到平衡状态的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.  不再变化
不再变化
d.c(I-)=y mol·L-1
(3)已知反应2HI(g) ![]() H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=___。
(2)工业合成氨气的反应为N2(g)+3H2(g)![]() 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是___。

其中表示平衡混合物中NH3的含量最高的一段时间是___。
(4)温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的化学平衡常数的为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g) ![]() 2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
起始 浓度 | c(H2)(mol/L) | c(I2)(mol/L) | c(HI)/(mol/L) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
甲中反应达到平衡时,测得c(H2)=0.008 mol/L下列判断正确的是( )
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

A. 根据图象无法确定改变温度后平衡移动方向
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a>c+d
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800°C时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g) H<0,测得n(NO)随时间的变化如下表:
2NO2(g) H<0,测得n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)NO的平衡浓度c(NO)=____________________。
(2)下图中表示NO2的变化的曲线______________。(填字母)
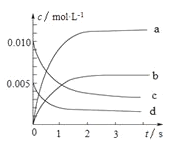
(3)能说明该反应已经达到化学平衡状态的是______________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=v正(O2) D.容器内NO、O2、NO2同时存在
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
A.及时分离出NO2气体B.适当升高温度
C.增大O2的浓度D.选择高效的催化剂
(5)下图中的曲线表示的是其它条件一定时,体系中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示v(正)<v(逆)的点是____________。(填选项)
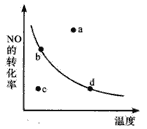
A.a B.b C.c D.d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com