
【题目】氨对人类的生产生活具有重要影响。
氨的制备与利用。
(1)工业合成氨的化学方程式是_______________。
氨的定量检测。水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

(2)利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________。
(3)若利用氨气传感器将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,则水样中氨氮(以氨气计)含量为_________mg·L-1。
(4)氨的转化与去除。 微生物燃料电池(MFC)是一种现代化氨氮去除技术。如图为MFC碳氮联合同时去除的氮转化系统原理示意图。

已知A、B两极生成CO2和N2的物质的量之比为5:2,写出A极的电极反应式:___________。
【答案】N2+3H2![]() 2NH3 c(OH-)增大,使NH4++OH-
2NH3 c(OH-)增大,使NH4++OH-![]() NH3H2O
NH3H2O![]() NH3+H2O平衡正向移动,利于生成氨气,被空气吹出 3.4 CH3COO--8e-+2H2O=2CO2+7H+
NH3+H2O平衡正向移动,利于生成氨气,被空气吹出 3.4 CH3COO--8e-+2H2O=2CO2+7H+
【解析】
(1)工业合成氨是利用氮气和氢气在高温高压催化剂的作用下反应生成氨气;
(2)氢氧根离子浓度增大会结合铵根离子利于生成氨气;
(3)若利用氨气传感器将1L水样中的氨氮完全转化为N2时,依据氮元素守恒和电子转移守恒计算水样中氨氮(以氨气计)含量;
(4)图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质。
(1)工业合成氨是利用氮气和氢气高温高压催化剂的作用下反应生成氨气,其反应的化学方程式为:N2+3H2![]() 2NH3;
2NH3;
(2)利用平衡原理分析含氨氮水样中加入NaOH溶液的作用是c(OH-)增大,使NH4++OH-![]() NH3H2O
NH3H2O![]() NH3+H2O平衡正向移动,利于生成氨气,被空气吹出;
NH3+H2O平衡正向移动,利于生成氨气,被空气吹出;
(3)将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,依据氮元素守恒有:2NH3~N2~6e-,可见,每有2molNH3反应,转移6mol电子,则转移电子的物质的量n(NH3)=2×10-4mol,由于溶液的体积是1L,所以c(NH3)=2×10-4mol/L;则水样中氨氮(以氨气计)含量=2×10-4mol/L×17g/mol=3.4×10-3g/L=3.4mg/L;
(4)图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质,则A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,B电极反应式为:2NO3-+12H++10e-=N2+6H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以下对化学反应描述的观点中正确的有几项:①放热反应在常温下均能自发进行;②电解过程中,化学能转化为电能而“储存”起来;③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;⑤盐类均能发生水解反应;⑥相同温度下,同一反应的化学平衡常数的大小与化学反应方程式的书写有关( )
A.1项B.2项C.3项D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验必须注意安全.下列做法不正确的是( )
A.不慎将浓碱沾到皮肤上,立即用大量水冲洗,再涂上![]() 的硼酸溶液
的硼酸溶液
B.在点燃或加热可燃气体前检验其纯度,防止发生爆炸
C.向正在燃烧的酒精灯里添加酒精
D.钠燃烧着火,应用干燥的沙土盖灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,c(HCN)+c(CN-)=0.1 mol·L-1的一组HCN和NaCN的混合溶液,溶液中 c(HCN)、c(CN-)与pH的关系如图所示。下列有关离子浓度关系叙述正确的是( )
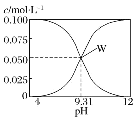
A.将 0.1 mol·L-1 的 HCN 溶液和 0.1 mol·L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+)
B.W 点表示溶液中:c(Na+)=c(HCN)+c(CN-)
C.pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1 mol·L-1+c(OH-)
D.将0.3 mol·L-1 HCN溶液和0.2 mol·L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=c(HCN)+3c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是 ( )
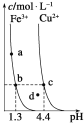
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的Ksp=1.8×10-10。常温下在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL0.01 mol·L-1 AgNO3溶液,下列说法正确的是 ( )
A.有AgCl沉淀析出B.无AgCl沉淀析出
C.无法确定D.有沉淀但不是AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M 均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法中不正确的是( )
![]()
A.若 M 是单质铁,则 Z 溶液可能是 FeCl2 溶液
B.若 M 是氢氧化钠,则 X 水溶液呈酸性
C.若 M 是氧气,则 X、Z 的相对分子质量可能相差 48
D.若 M 是强氧化性的单质,则 X 可能是金属铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有离子:K+、Na+、Fe2+、Fe3+、SO32-、SO42-,且溶液中各离子的物质的量相等,将此溶液分为两份,一份加高锰酸钾溶液,现象为紫色褪去,另一份加氯化钡溶液,产生了难溶于水的沉淀。下列说法正确的是( )
A.若溶液中含有硫酸根,则可能含有K+
B.若溶液中含有亚硫酸根,则一定含有K+
C.溶液中可能含有Fe3+
D.溶液中一定含有Fe2+和SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是

A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com