
【题目】食品加工中常用焦亚硫酸钠(Na2S2O5)作漂白剂、防腐剂和疏松剂。现实验室欲制备焦亚硫酸钠,其反应依次为:(ⅰ)2NaOH+SO2=Na2SO3+H2O;
(ⅱ)Na2SO3+H2O+SO2=2NaHSO3;
(ⅲ)2NaHSO3![]() Na2S2O5+H2O。
Na2S2O5+H2O。
查阅资料:焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。
实验装置如下:
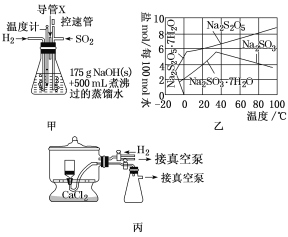
(1)实验室可用废铝丝与NaOH溶液制取H2,其离子方程式为___。
(2)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为__。实验后期须利用水浴使温度保持在约80℃。
(3)反应后的体系中有少量白色亚硫酸钠析出,除去其中亚硫酸钠固体的方法是___;然后获得较纯的无水Na2S2O5,应将溶液冷却到30℃左右过滤,控制“30℃左右”的理由是___。
(4)丙为真空干燥Na2S2O5晶体的装置,通入H2的目的是___。
(5)常用剩余碘量法测定产品中焦亚硫酸钠的质量分数。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2=S4O62-+2I-。请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积的已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。
④___。
⑤重复步骤①~③;根据相关记录数据计算出平均值。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ SO2与NaOH溶液的反应是放热反应 趁热过滤 此时溶液中Na2SO3不饱和,不析出 排出空气,防止焦亚硫酸钠被氧化 加入少量淀粉溶液,继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复色,记录滴定所消耗的体积
【解析】
(1)铝和NaOH溶液反应生成偏铝酸钠和氢气;
(2)SO2与NaOH溶液的反应是放热反应导致溶液温度升高;
(3)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小;控制“30℃左右”时,此时溶液中Na2SO3不饱和;
(4)焦亚硫酸钠能被压强氧化;真空干燥时,干燥室内部的压力低,水分在低温下就能气化;
(5)④碘能使淀粉变蓝色,所以可以用淀粉试液检验滴定终点,继续做实验为:加入少量淀粉溶液,继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积。
(1)铝和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)SO2与NaOH溶液的反应是放热反应导致溶液温度升高,所以溶液“温度迅速升高”;
(3)根据图知,温度越高Na2S2O5溶解度增大,当接近40℃时亚硫酸钠溶解度减小,所以要趁热过滤;控制“30℃左右”时,此时溶液中Na2SO3不饱和,不析出;
(4)焦亚硫酸钠能被压强氧化,则通入氢气的目的是排出空气,防止焦亚硫酸钠被氧化;
(5)④继续做实验为:加入少量淀粉溶液,继续用标准Na2S2O3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积,然后再重复实验,减少实验误差。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
②苯环上的取代基对新导入的取代基进入苯环的位置有显著的影响。如图表示以苯为原料制备一系列有机物的转化过程:
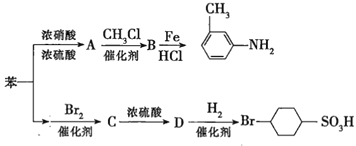
(1)![]() 是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为
是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为![]() 的化学方程式是______。
的化学方程式是______。
(2)在“苯![]() ”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
(3)有机物![]() 苯环上的二氯代物有__________种结构;
苯环上的二氯代物有__________种结构;![]() 的所有原子____(填“在”或“不在”)同一平面上。
的所有原子____(填“在”或“不在”)同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 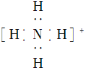 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别以下列各组物质作为单体在一定条件下,通过缩聚反应能合成高分子化合物的是( )
①乙烯、丙烯、苯乙烯
②乙酸、乙二醇
③1,![]() 己二酸、1,
己二酸、1,![]() 己二胺
己二胺
④对苯二甲酸、乙二醇
⑤α-氨基乙酸、α-氨基丙酸
⑥α-羟基丙酸
A.①③⑤⑥B.①②③④C.③④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯通过聚合反应可得到高分子材料
B. 聚丙烯的结构单元是—CH2-CH2-CH2—
C. 碳纤维属于合成有机高分子化合物
D. 聚乙烯塑料的老化是因为发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=_________pm,Mg原子之间最短距离y=_________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是_________g·cm-3(列出计算表达式)。
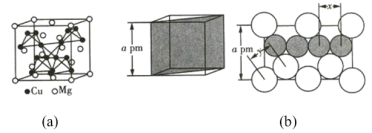
(2)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为__________;通过测定密度![]() 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=____g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子的坐标为(
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=____g·cm-3。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子的坐标为(![]() ,
,![]() ,
,![]() )则原子2和3的坐标分别为__________、__________。
)则原子2和3的坐标分别为__________、__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠( Na2CO4)是一种很好的供氧剂,其与稀盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下两种方案实施:
方案一:![]()
(1)操作①和③的名称分别为
(2)上述操作中,使用到玻璃棒的有 __(填操作序号)。
(3)请简述操作③的操作过程
方案二:按下图安装好实验装置,Q为一塑料气袋,随意取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴入气袋中至充分反应。
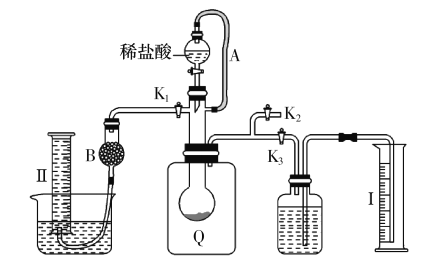
(4)为测定反应生成气体的总体积,滴稀盐酸前必须关闭 ,打开 (填“K1”、“K2”或“K3”)。导管a的作用是 。
(5)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开Kl。 B中装的固体试剂是 ,为何要缓缓打开K1? 。
(6)实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到了ymL气体,则样品中过碳酸钠的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com