
| n |
| V |
| 1.5mol |
| 1L |


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、作质谱分析,质谱图中质荷比的最大值为46 |
| B、作红外光谱分析,谱图上有C-H、C-O和O-H键的吸收峰 |
| C、作核磁共振氢谱分析,在谱图中出现3个吸收峰,其强度比为3:2:1 |
| D、向CH3-CH2-OH中加入金属钠,有H2放出,证明该有机物显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu+HNO3(浓)→Cu(NO3)2 | ||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | ||||
C、Cu
| ||||
| D、Cu+AgNO3→Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(H2)/mol | 0.11 | 0.09 | 0.07 | 0.07 |
| A、反应前2min的平均速率υ(H2)=0.0075mol/(L?min) |
| B、其他条件不变,升高温度,反应达到新平衡前υ(正)>υ(逆) |
| C、其他条件不变,充入0.2molH2,再次达到平衡时,CH3OH的体积分数增大 |
| D、第2~4min、第4~7min,H2的平均速率:υ(2~4)=υ(4~7) |
查看答案和解析>>
科目:高中化学 来源: 题型:
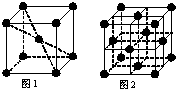
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期数 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | m(KClO3)/g | m(MnO2)/g | m(CuO)/g | 回收催化剂质量/g |
| ① | 0.6000 | -- | -- | -- |
| ② | a | 0.2000 | -- | 0.1950 |
| ③ | b | -- | c | 0.1900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com