
【题目】氨的合成与应用一直是众多科学家研究的热门话题,目前该研究领域已经催生了三位诺贝尔化学奖得主,N2不仅可以与H2合成氨气,N2还可以与其他物质反应生成氨气,回答下列相关问题:
(1)德国化学家哈伯研究“N2(g)+3H2(g)![]() 2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2
2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2
①若从平衡常数角度分析,反应限度已经较大,但为何化工生产中还需要使用催化剂:____________________________________________
②升高温度,反应物的转化率会降低,而实际化工生产中常常采用700K左右的温度,其原因是____________________________________________。
(2)1931年,科学家卡尔博施因改进合成氨方法而荣获该年度诺贝尔化学奖。研究发现,催化剂Fe3O4·Al2O3)颗粒大小不同、温度不同,平衡混合气体中氨气的含量不同由如图可以得出合成氨的适宜条件是_________________________________

(3)2007年,德国埃特尔发现了合成氨催化机理,开端了表面动力学的研究。研究发现,常温恒压密闭容器中,N2在催化剂表面可以与水发生反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
①下列各项能够作为判断该反应一定达到平衡的依据是___________(填标号)。
A.容器中N2(g)、NH3(g)、O2(g)的浓度之比为2:4:3
B.N2与NH3浓度之比恒定不变
C.v(N2)正=2v(NH3)逆
D.混合气体中氨气的质量分数不变
E.压强保持不变
②平衡后若分别改变下列一个条件,可以使N2转化率增大的是___________(填标号。)
A.转移掉部分O2 B.转移掉部分NH3
C.适当增加H2O(l)的量 D.增加N2的量
(4)科学研究发现,天然气CH4(g)与N2(g)在催化剂作用下可以直接用于合成氨气,同时生成副产物焦炭,已知每转移1mol电子,该反应吸收的热量为QkJ。
①写出该反应的热化学反应方程式_________________________________
②700℃时,将3molCH4与3molN2在2L的恒定密闭容器中发生上述反应,达到平衡时生成 amolC,求此时混合气体中氨气的体积分数______________________(用含a的数学表达式即可,下同);该温度下的平衡常数Kc=_________________________________。
【答案】使用催化剂,主要目的是加快反应速率,提高单位时间内的产量。 该温度下,催化剂的活性大,催化效率高,反应速率快,此温度下,虽然反应限度有所降低,但综合考虑,单位时间内的产量仍较高。 470℃左右、0.6mm粒度大小的催化剂(Fe3O4·Al2O3) B、D A、B 3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g) ΔH=+12QkJ/mol
3C(s)+4NH3(g) ΔH=+12QkJ/mol ![]()
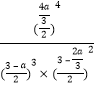
【解析】
(1)①催化剂可以加快化学反应速率,缩短达到平衡所需要的时间,从而可以提高单位时间内的产量。
②合成氨气的正反应是可逆的放热反应,升高温度,化学平衡向逆反应方向移动,使反应物的转化率会降低,但实际化工生产中常常采用700K左右的温度,主要原因是在该温度下催化剂的活性大,催化效率高,反应速率快,综合考虑,单位时间内的产量仍较高。
(2)根据图示可知在相同温度下,颗粒越细小,转化率越高;相同颗粒,在温度为470℃左右时转化率最高,所以最合适的反应条件是470℃左右、0.6mm粒度大小的催化剂(Fe3O4·Al2O3);
(3)①A.方程式中N2(g)、NH3(g)、O2(g)的系数比就是2:4:3,所以N2(g)、NH3(g)、O2(g)的浓度之比为2:4:3可能是反应处于平衡状态,也可能未达到平衡状态,不能作为判断平衡的标志,A错误;
B. N2是反应物,NH3是生成物,若二者浓度之比恒定不变,则反应达到平衡状态,B正确;
C.任何时刻,v(N2)正:v(NH3)正=2:4,若反应达到平衡,则v(NH3)正= v(NH3)逆,则平衡时v(N2)正:v(NH3)逆=2:4,所以2v(N2)正=v(NH3)逆,故该状态不是平衡状态,C错误;
D. 该反应是反应前后气体体积不等的反应,若混合气体中氨气的质量分数不变,则反应处于平衡状态,D正确;
E.该反应是在恒温恒压下进行,任何时刻压强保持不变,不能作为判断平衡的标准,E错误;
故合理选项是BD;
②A.转移掉部分O2,即减小生成物浓度,平衡正向移动,可以提高N2转化率,A正确;
B.转移掉部分NH3,即减小生成物浓度,平衡正向移动,可以提高N2转化率,B正确;
C.由于水的状态是液态,改变其物质的量,平衡不移动,所以不能改变N2转化率,C错误;
D.增加N2的量,该物质本身浓度增大,平衡正向移动,但是平衡正向移动消耗量小于加入量,总的来说它的转化率还是降低,D错误;
故合理选项是AB;
(4) ①根据题意,结合原子守恒、电子守恒,可得热化学方程式:3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g) ΔH=+12QkJ/mol;
3C(s)+4NH3(g) ΔH=+12QkJ/mol;
② 3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g) ΔH=+12QkJ/mol
3C(s)+4NH3(g) ΔH=+12QkJ/mol
n(开始) (mol) 3 3 0 0
n(转化) (mol) a ![]() a
a ![]()
n(平衡) (mol) 3-a 3-![]() a
a ![]()
所以达到平衡时混合气体中氨气的体积分数是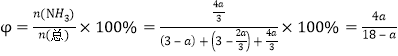 ;
;
根据平衡常数的含义可得:该温度下的平衡常数Kc=


科目:高中化学 来源: 题型:
【题目】化合物G是一种低毒性、低残留、环境友好的农药,可以通过以下方法合成。

(1)A→B的反应类型为______________。
(2)下列说法不正确的是________。
A.化合物B能使Br2/CCl4溶液褪色 B.化合物A能发生银镜反应
C.化合物C能与FeCl3发生显色反应 D.化合物E的分子式为C12H12Cl2O2
(3)化合物C中的含氧官能团名称为________和________。
(4)化合物X的分子式为C5H12O2,则X的结构简式为______________。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式:__________。①属于芳香族化合物且能发生银镜反应②分子中只有3种不同化学环境的氢
(6)请以![]() 为原料制备化合物
为原料制备化合物![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_________________。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, 在pH都等于5的NH4Cl和CH3COOH两种溶液中,设由水电离产生的H+ 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
A. A < B B. A = 10-4 B C. B = 10-4 A D. A = B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式表达正确的是
A. 碳酸钡跟醋酸反应:BaCO3+2CH3COOH=Ba2++2CH3COO-+CO2↑+H2O
B. 碳酸氢钠溶于水的电离方程式:NaHCO3![]() Na++H++CO32-
Na++H++CO32-
C. 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
D. 氧化钠固体上滴加稀盐酸:O2-+2H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl—、Br—、CO32-、SiO32-、SO42-中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法正确的是
A.溶液X中一定不含Ca2+、Br—、Fe2+
B.溶液X中一定含有Na+、Cl—和SiO32-
C.为确定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液
D.白色沉淀为AgCl和Ag2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将同体积同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中的Cl-完全沉淀,则需同物质的量浓度的AgNO3溶液的体积比为 ( )
A. 1∶2∶3 B. 3∶2∶1 C. 1∶1∶1 D. 6∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com