
| A、Na2CO3 C CO2 CO NaHCO3 |
| B、Na2S S SO2 Na2SO3 Na2SO4 |
| C、NH4Cl N2 NaNO2 NO2 HNO3 |
| D、P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述四种元素的原子半径大小为Y<X<W |
| B、W、X、Y原子的核外最外层电子数的总和为10 |
| C、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A和气体B的摩尔质量之比为b:a |
| B、同温同压下,气体A和气体B的密度之比为b:a |
| C、质量相同的气体A与气体B的分子数之比为a:b |
| D、相同状况下,同体积的气体A与气体B的质量之比为a:b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3═Na++H++CO32- |
| B、NaHSO4═Na++H++SO42- |
| C、FeCl3═Fe3++3Cl- |
| D、Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
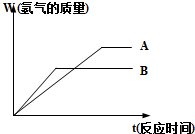 等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:| 实验序号 | 甲 | 乙 | 丙 |
| 混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
| 生成气体气体(mL) | 2240 | 5600 | 5600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com