
 如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题:
如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题:| 光照 |
| 光照 |
| 光照 |
| 光照 |
| ||
| ||
| 点燃 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某一位同学为了测定三聚氰胺的分子式,设计了如图实验:
某一位同学为了测定三聚氰胺的分子式,设计了如图实验:| 装置 | C | D |
| 实验前 | 101.0g | 56.0g |
| 实验后 | 106.4g | 69.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:2:1 |
| C、2:3:1 |
| D、2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
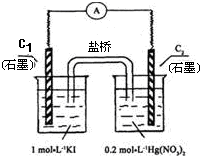
| A、C1电极上发生的反应是:2I--2e-=I2 |
| B、如图装置的电流方向是从C1到C2 |
| C、盐桥中的K+离子向C1电极移动 |
| D、装置发生的总反应是Hg2++2I-=HgI2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com