
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 6 |
| 0.7mol��2 |
| 7 |
| 0.7mol��1 |
| 7 |
| 0.7mol��11 |
| 7 |
| 0.1mol |
| 0.5L |
| 0.2mol |
| 0.5L |
| 1.1mol |
| 0.5L |


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
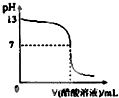 �����£���10mL 0.1mol?L-1NaOH��Һ����μ���0.1mol?L-1������Һ�����õζ�������ͼ��ʾ������˵����ȷ���ǣ�������
�����£���10mL 0.1mol?L-1NaOH��Һ����μ���0.1mol?L-1������Һ�����õζ�������ͼ��ʾ������˵����ȷ���ǣ�������| A��pH=7ʱ�����Ӵ�����Һ�����Ϊ10mL |
| B��pH��7ʱ����Һ��c��CH3COO-����c��Na+�� |
| C���������10mlʱ��c��Na+���Tc��CH3COOH��+c��CH3COO-�� |
| D�������μ�0.1 mol?L-1������Һ����ҺpH���Ա�Ϊ1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ����ʾ��U�ιܵ���˱�ˮ�ͽ�������м���������������Ϊ1��4���Ļ�����壬�ٶ�������ˮ�е��ܽ�ȿ��Ժ��ԣ�������м���������Ļ�������װ�÷������й�ĵط����û�����建���ط�Ӧһ��ʱ�䣮�Իش��������⣺
��ͼ����ʾ��U�ιܵ���˱�ˮ�ͽ�������м���������������Ϊ1��4���Ļ�����壬�ٶ�������ˮ�е��ܽ�ȿ��Ժ��ԣ�������м���������Ļ�������װ�÷������й�ĵط����û�����建���ط�Ӧһ��ʱ�䣮�Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��
| ||
B��
| ||
C��
| ||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��Cl2
| |||||||||
B��Cl2
| |||||||||
C��Cl2
| |||||||||
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������ȼ�ϵ�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ�ijȼ�ϵ�������ڵ�K2CO3�����в���O2-��HCO3-��Ϊ����ʣ��Զ���Ϊȼ�ϣ��Կ���Ϊ���������Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�������缫��ӦʽΪ��O2+2CO2+4e-�T2CO32-���Իش��������⣺
������ȼ�ϵ�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ�ijȼ�ϵ�������ڵ�K2CO3�����в���O2-��HCO3-��Ϊ����ʣ��Զ���Ϊȼ�ϣ��Կ���Ϊ���������Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�������缫��ӦʽΪ��O2+2CO2+4e-�T2CO32-���Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
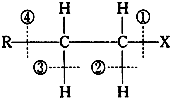
| A����±��������ˮ�ⷴӦʱ�����ƻ��ļ��Ǣٺ͢� |
| B����±��������ˮ�ⷴӦʱ�����ƻ��ļ��Ǣ� |
| C����±����������ȥ��Ӧʱ�����ƻ��ļ��Ǣٺ͢� |
| D����±����������ȥ��Ӧʱ�����ƻ��ļ��Ǣٺ͢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
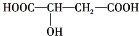 ������˵������ȷ���ǣ�������
������˵������ȷ���ǣ�������| A��ƻ������һ���������ܷ���������Ӧ |
| B��ƻ������һ���������ܷ�����������Ӧ |
| C��1 molƻ��������2 mol��Na������Ӧ |
| D��1 molƻ������Na2CO3��Һ��Ӧ�������3 mol Na2CO3 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com