
 ������ȼ�ϵ�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ�ijȼ�ϵ�������ڵ�K2CO3�����в���O2-��HCO3-��Ϊ����ʣ��Զ���Ϊȼ�ϣ��Կ���Ϊ���������Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�������缫��ӦʽΪ��O2+2CO2+4e-�T2CO32-���Իش��������⣺
������ȼ�ϵ�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ�ijȼ�ϵ�������ڵ�K2CO3�����в���O2-��HCO3-��Ϊ����ʣ��Զ���Ϊȼ�ϣ��Կ���Ϊ���������Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�������缫��ӦʽΪ��O2+2CO2+4e-�T2CO32-���Իش��������⣺
| ||
| ||
| ||
| 0.65mol |
| 2 |
| 0.65mol |
| 6.5��4 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ijһλͬѧΪ�˲ⶨ�����谷�ķ���ʽ���������ͼʵ�飺
ijһλͬѧΪ�˲ⶨ�����谷�ķ���ʽ���������ͼʵ�飺| װ�� | C | D |
| ʵ��ǰ | 101.0g | 56.0g |
| ʵ��� | 106.4g | 69.2g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
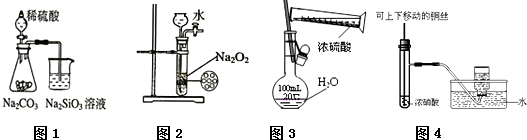
| A��ͼ1Ϊ֤���ǽ�����ǿ����S��C��Si |
| B��ͼ2Ϊ�Ʊ��������� |
| C��ͼ3Ϊ����һ�����ʵ���Ũ�ȵ�������Һ |
| D��ͼ4Ϊ�Ʊ����ռ�����NO2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʳƷ���Ӽ���ʳƷ����������ɫʳƷ |
| B��ά����C���л�ԭ�ԣ������������������� |
| C��Ϊ��ֹ�±��ȸ�֬ʳƷ�������ʣ����ڰ�װ���з����������� |
| D������������Ա��������Χ��ʯ�ң��������ǽ��л�����������ֹ�ֺ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��c ��CH3COO-����c ��Na+�� |
| B��c ��CH3COOH��+c ��CH3COO-��=0.01mol/L |
| C��c ��CH3COOH����c ��CH3COO-�� |
| D��c ��OH-����c ��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1��1 | B��1��6 |
| C��2��3 | D��3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������������У���������ͼ����һ��ת����ϵ��ѡ���ǣ�������
������������У���������ͼ����һ��ת����ϵ��ѡ���ǣ�������| ѡ�� | X | Y | Z |
| A | Al2O3 | AlCl3 | Al��OH��3 |
| B | CuO | CuSO4 | Cu��OH��2 |
| C | Al2O3 | Na[Al��OH��4] | Al��OH��3 |
| D | Si | SiO2 | H2SiO3 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com