
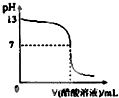
 常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )| A、pH=7时,所加醋酸溶液的体积为10mL |
| B、pH<7时,溶液中c(CH3COO-)<c(Na+) |
| C、醋酸滴入10ml时,c(Na+)═c(CH3COOH)+c(CH3COO-) |
| D、继续滴加0.1 mol?L-1醋酸溶液,溶液pH可以变为1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
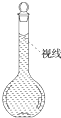 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:
 某一位同学为了测定三聚氰胺的分子式,设计了如图实验:
某一位同学为了测定三聚氰胺的分子式,设计了如图实验:| 装置 | C | D |
| 实验前 | 101.0g | 56.0g |
| 实验后 | 106.4g | 69.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:2:1 |
| C、2:3:1 |
| D、2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com