
【题目】碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是
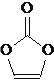
A. 该物质在一定条件下可发生水解反应
B. 分子中含6个σ键
C. 分子中只有极性键
D. 8.6g该物质完全燃烧得到6.72LCO2
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。请回答下列问题:
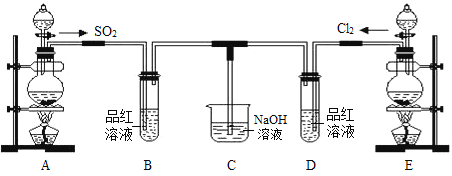
(1)实验室用装置E制备Cl2,其反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O。将上述化学方程式改写为离子方程式_______________________________。
MnCl2 + Cl2↑ + 2H2O。将上述化学方程式改写为离子方程式_______________________________。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象(填选项序号,下同)。
A.品红溶液都褪色 B.品红溶液都不褪色
C.B中品红溶液褪色,D中不褪色 D.D中品红溶液褪色,B中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的溶液呈现的颜色分别为________。
A.无色、红色 B.无色、无色 C.红色、红色 D.红色、无色
(3)C烧杯中氢氧化钠溶液的作用是_____________________________,写出Cl2通入NaOH溶液中的化学方程式_______________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按物质的量之比1︰1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请分析该现象的原因(用离子方程式表示)_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4N3(叠氮化铵)易发生爆炸反应: NH4N3![]() 2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8gNH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L (标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是_______________________。
(2)气态氢化物稳定性:NH3 ______________ AsH3,其主要原因是___________________。
(3)①肼(N2H4)分子可视为NH3分子中的一个氢原子被NH2(氨基)取代形成的另一种氮的氢化物。则N2H4电子式为_______________。
②工业上将NH3或(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为_______________,1 mol(CH3)2 CO中的π键数目为___________。
③N2H4分子中存在的共价键类型有________(填选项字母)。
A.非极性键 B.极性键 C.s-s σ键 D.s-p σ键
E.p-p π键 F.s-sp3 σ键 G.sp3-sp3 σ键 H.sp3-sp3 π键
(4)已知N2H5+与N2H62+是由中性分子结合质子形成的,有类似于 NH4+的性质。
①写出N2H62+在碱性溶液中反应的离子方程式:_________________________________。
②据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是____________。
(5)Na3AsO4可作杀虫剂。AsO![]() 的空间构型为__________,与其互为等电子体的一种分子为________。
的空间构型为__________,与其互为等电子体的一种分子为________。
(6)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为__________,砷原子采取___________杂化。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道美国准备试验绿色航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,结构如图,它比肼燃烧释放能量更高,更安全、环保。下列说法不正确的是( )

A.羟基硝酸铵中各原子共平面
B.固态时羟基硝酸铵是离子晶体
C.羟基硝酸铵中含有离子键和共价键
D.9.6g羟基硝酸铵中含有0.2NA个离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:_____H2O2 +___Cr2(SO4)3 +_______KOH=________K2CrO4 +________K2SO4 +_______H2O
(1)配平该方程式,并用单线桥法表示电子转移情况。
(2)此反应中氧化剂是__________。
(3)若消耗1molL-1Cr2(SO4)3溶液的体积为50mL,则转移电子的物质的量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从1L1 mol/L的NaOH溶液中,取出50mL溶液,该50mL NaOH溶液的物质的量浓度为
A.0.02mol/L B.0.2mol/L C.1 mol/L D.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2,下列有关判断正确的是(提示:SOCl2中S显![]() 价)
价)
A. 还原剂只有Li
B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S
D. 生成1.12LSO2时,反应转移电子为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com