
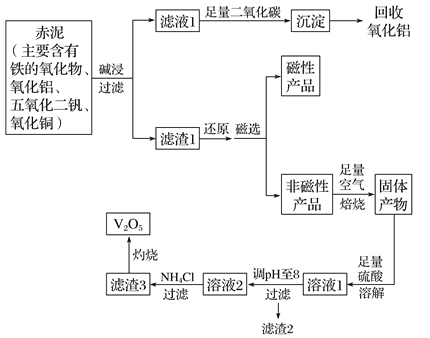
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
【答案】(1)a (2)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ (3)Fe (4)VO2+转化为VO3-
(5)NH4VO310Al+3V2O5![]() 5Al2O3+6V
5Al2O3+6V
【解析】试题分析:(1)氧化铝不能溶解在弱碱中,则选择强碱氢氧化钠,答案选a;
(2)滤液1中含有偏铝酸钠,与足量二氧化碳反应的离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓。
(3)铁不能溶解在氢氧化钠中,则滤渣1中含有铁,所以磁选步骤得到的磁性产品为铁;
(4)由于NH4VO3难溶,所以溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使VO2+转化为VO3-。
(5)由于NH4VO3难溶,所以滤渣3的主要成分为NH4VO3,根据电子得失守恒和原子守恒可知钙铝热反应的方程式为10Al+3V2O5![]() 5Al2O3+6V。
5Al2O3+6V。


科目:高中化学 来源: 题型:
【题目】核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示
(1)五种元素形成的单质,其中固态时属于原子晶体的是________(填化学式);常用作强氧化剂的是________、________(填化学式)。
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,请用电子书表示该化合物中化学键的形成过程___________________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是______________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧放出140 kJ的热,写出该化合物燃烧热的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________(填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol CH4分子所含质子数为1.6 NA
B. 在0℃,101kPa时,22.4 L H2中含有NA个氢原子
C. 16 g氧气和16 g臭氧所含的原子数均为NA
D. NA个CO分子和11.2L CH4的质量比为7:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,全国特大“地沟油”案件宣判大快人心.“地沟油”中含有大量的油脂,油脂是多种高级脂肪酸的甘油酯.下列说法不正确的是
A.通过适当方法,可将“地沟油”用于生产燃料
B.地沟油有毒,不能回收利用,只能排入下水道
C.地沟油在碱性条件下可水解为甘油和高级脂肪酸盐
D.地沟油可用作化工原料,如生产肥皂等产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
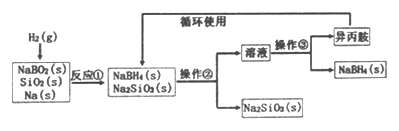
下列说法不正确的是
A. 反应①的化学方程式为 NaBO2+2SiO2+4Na+2H2=NaBH4+2Na2SiO3
B. 反应①加料之前需将反应器加热至100℃以上并通入氩气
C. 操作②、操作③分别是过滤与蒸发结晶
D. NaBH4在水溶液中分解的离子方程式BH4-+2H2O=BO2-+4H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com