
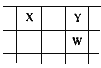
【题目】核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示
(1)五种元素形成的单质,其中固态时属于原子晶体的是________(填化学式);常用作强氧化剂的是________、________(填化学式)。
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,请用电子书表示该化合物中化学键的形成过程___________________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是______________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧放出140 kJ的热,写出该化合物燃烧热的热化学方程式:_______________________________。
【答案】 C O2 Cl2 Na S2﹣>Cl﹣>Na+ HClO4>H2SO4>H2CO3 ![]() 离子 2Cl-﹣2e-=Cl2↑ Cl2+2NaOH=NaCl+NaClO+H2O C6H12O6 (s)+6O2(g)=6 CO2(g)+6H2O(l) △H=﹣2800kJ/mol
离子 2Cl-﹣2e-=Cl2↑ Cl2+2NaOH=NaCl+NaClO+H2O C6H12O6 (s)+6O2(g)=6 CO2(g)+6H2O(l) △H=﹣2800kJ/mol
【解析】试题分析:W的单质是淡黄色固体,W是S元素;在同周期中,Z的金属性最强,Q的非金属性最强,Z是Na、Q是Cl;根据X、Y、W在周期表中的相对位置关系,X、Y分别是C、O;
解析:根据以上分析,(1)五种元素形成的单质,其中固态时属于原子晶体的是C;非金属越性强常,氧化性越强,用作强氧化剂的是O2 、Cl2。
(2)电子层数越多半径越大,同周期元素从左到右半径减小,这五种元素中,原子半径最大的是Na;由Z、W、Q形成的简单离子半径由大到小的顺序是S2﹣>Cl﹣>Na+;非金属性越强最高价氧化物的水化物酸性越强,X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是HClO4>H2SO4>H2CO3。
(3)Y和Z形成的一种化合物中含有离子键和共价键的化合物是过氧化钠,用电子书表示该化合物中化学键的形成过程![]() 。
。
(4)活泼金属与活泼非金属元素形成的化合物为离子化合物,Na与Cl反应生成的化合物氯化钠属于离子化合物;电解氯化钠的饱和溶液,阳极生成氯气,阳极的电极反应式为2Cl-﹣2e-=Cl2↑;阴极生成氢气和氢氧化钠溶液,电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6是葡萄糖C6H12O6, 9 g该化合物燃烧放出140 kJ的热,则1mol C6H12O6燃烧放热2800kJ,该化合物燃烧热的热化学方程式C6H12O6 (s)+6O2(g)=6 CO2(g)+6H2O(l) △H=﹣2800kJ/mol。


科目:高中化学 来源: 题型:
【题目】聚β羟丁酸作为一种天然高分子聚合物,具有生物相容性、生物可降解性、无免疫原性和组织相容性等特殊功能,在药物缓释控释系统、骨科以及医用手术缝合线领域有广泛的应用。以A为原料合成聚β羟丁酸的路线如下图:

已知:①芳香环在钠和醇的液氨溶液中能够被还原成1,4环己二烯;
② ;
;
③![]() 。
。
回答下列问题:
(1)A的分子式是__________。下列关于芳香烃的结构与性质的说法正确的是_______(填标号)。
a.芳香烃均含苯环,含苯环的有机物均为芳香烃
b.芳香烃均能发生加成反应
c.芳香烃都不能使酸性KMnO4溶液褪色
d.部分芳香烃能使溴的CCl4溶液褪色
(2)D的化学名称是_________。
(3)B结构简式是_________,C中含有的官能团是__________________。
(4)D生成E的化学方程式是___________________________,该反应的反应类型是_________。
(5)试剂X的同分异构体满足下列条件的共有_________种(不含立体异构)。
①遇FeCl3溶液有显色反应;②能与NaHCO3反应放出CO2。
其中核磁共振氢谱显示为5组峰,且峰面积比为1∶1∶2∶2∶2的是___________(写结构简式)。
(6)参照上述合成路线,以间二甲苯( )为原料(无机试剂任选),设计环酯
)为原料(无机试剂任选),设计环酯 的合成路线:____________________________________。
的合成路线:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
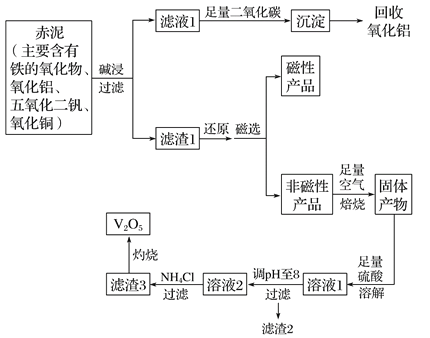
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是

A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式_________________________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“>”或“<”)
(3)AsCl3分子的立体构型为______________,其中As的杂化轨道类型为__________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_____________。(已知:晶胞内As原子之间彼此不相切)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应的下列说法正确的是( )
A. 每生成1 mol N2转移的电子的物质的量为6 mol
B. N2既是氧化剂,又是还原剂
C. NH4Cl中的氮元素被还原
D. NaNO2是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,沉淀减少到4.66g,并有气体产生。
(1)写出有关离子方程式 。
(2)原混合物溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(3)产生的气体在标准状况下的体积是多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关合金的叙述正确的是
A. 合金的导电性比成分金属强 B. 生铁的抗腐蚀性能比纯铁好
C. 合金的机械强度比各成分金属小 D. 多数合金比成分金属熔点低,硬度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
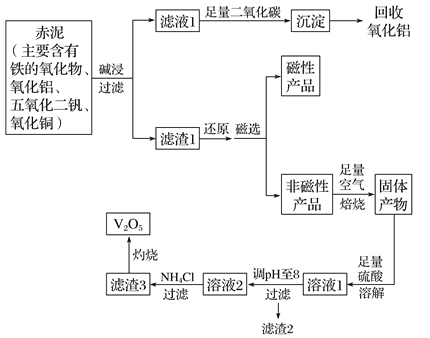
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com