
【题目】向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,沉淀减少到4.66g,并有气体产生。
(1)写出有关离子方程式 。
(2)原混合物溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(3)产生的气体在标准状况下的体积是多少升?
【答案】(1)Ba2++SO42-=BaSO4↓、Ba2++ CO32-= BaCO3↓、BaCO3+2H+= Ba 2++CO2↑+H2O;(2)c(Na2SO4)=0.4mol/L、c(Na2CO3)=1mol/L;(3)1.12L
【解析】试题分析:本题考查离子方程式的书写,物质的量在化学方程式计算中的应用。
(1)Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液发生反应的离子方程式为:Ba2++SO42-=BaSO4↓、Ba2++ CO32-= BaCO3↓。得到的白色沉淀为BaSO4和BaCO3的混合物,加入过量稀HCl,只有BaCO3溶解,反应的离子方程式为BaCO3+2H+= Ba 2++CO2↑+H2O。
(2)加入过量稀HCl后得到的4.66g沉淀为BaSO4,n(Na2SO4)=n(BaSO4)=![]() =0.02mol,原混合溶液中c(Na2SO4)=
=0.02mol,原混合溶液中c(Na2SO4)=![]() =0.4mol/L。m(BaCO3)=14.51g-4.66g=9.85g,n(Na2CO3)=n(BaCO3)=
=0.4mol/L。m(BaCO3)=14.51g-4.66g=9.85g,n(Na2CO3)=n(BaCO3)=![]() =0.05mol,原混合溶液中c(Na2CO3)=
=0.05mol,原混合溶液中c(Na2CO3)=![]() =1mol/L。
=1mol/L。
(3)根据C守恒,n(CO2)=n(Na2CO3)=0.05mol,在标准状况下CO2的体积为0.05mol![]() 22.4L/mol=1.12L。
22.4L/mol=1.12L。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:
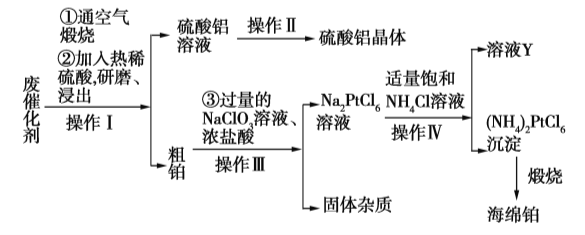
请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)写出第③步反应的离子方程式:_____________________________。
(4)此流程中的四个操作中有三个是相同的,其名称是__________,在实验室进行此操作使用的主要玻璃仪器有___________________。溶液Y中可以循环使用的物质是____________(填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示
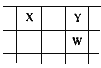
(1)五种元素形成的单质,其中固态时属于原子晶体的是________(填化学式);常用作强氧化剂的是________、________(填化学式)。
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,请用电子书表示该化合物中化学键的形成过程___________________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是______________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧放出140 kJ的热,写出该化合物燃烧热的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 乙电极附近溶液的pH减小
B. 电极丁的反应式为:MnO42―― e- === MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 导线中有2 mol电子通过时,理论上有2 mol K+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在具有下列电子排布式的原子中,原子半径最大的是( )
A. 1s22s22p63s23p1 B. 1s22s22p1 C. 1s22s22p3 D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色的酸性溶液中,下列离子组能大量共存的是( )
A.Ba2+、K+、Cl-、NO3-
B.Fe3+、Na+、Cl-、S2-
C.Al3+、Na+、CO32-、NO3-
D.Fe2+、Mg2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,全国特大“地沟油”案件宣判大快人心.“地沟油”中含有大量的油脂,油脂是多种高级脂肪酸的甘油酯.下列说法不正确的是
A.通过适当方法,可将“地沟油”用于生产燃料
B.地沟油有毒,不能回收利用,只能排入下水道
C.地沟油在碱性条件下可水解为甘油和高级脂肪酸盐
D.地沟油可用作化工原料,如生产肥皂等产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com