
【题目】某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:
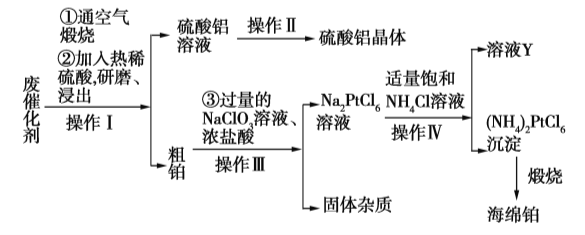
请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)写出第③步反应的离子方程式:_____________________________。
(4)此流程中的四个操作中有三个是相同的,其名称是__________,在实验室进行此操作使用的主要玻璃仪器有___________________。溶液Y中可以循环使用的物质是____________(填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
【答案】(1)除去废催化剂中的石墨(2分)
(2)增大反应物的接触面积,加快浸出速率(2分)
(3)3Pt+2![]() +12H++16Cl
+12H++16Cl![]() 3
3![]() +6H2O(2分)
+6H2O(2分)
(4)过滤(1分) 普通漏斗、烧杯、玻璃棒(3分) NaClO3和HCl(2分)
(5)15%(3分)
【解析】(1)废催化剂(主要含Pt、Al2O3、石墨)中,Pt、Al2O3不会被氧气氧化,而石墨会被氧化成CO2气体而去除,故第①步通入空气煅烧的目的是除去废催化剂中的石墨。
(2)第②步是固液反应,用热酸研磨浸出而不是直接浸出的原因是增大反应物的接触面积,加快浸出速率。
(3)根据流程图可判断反应产物中有Na2PtCl6,再根据氧化还原反应规律,写出该反应的离子方程式:3Pt+2![]() +12H++16Cl
+12H++16Cl![]() 3
3![]() +6H2O。
+6H2O。
(4)此流程中的四个操作中Ⅰ、Ⅲ、Ⅳ都是固液分离,是过滤,在实验室进行过滤操作使用的主要玻璃仪器有普通漏斗、烧杯、玻璃棒。在溶液Y中含有过量的NaClO3溶液和浓盐酸,在第③步可使用。(5)EDTA总物质的量为0.0004 mol,与Zn2+反应的EDTA物质的量为0.0001 mol,与Al3+反应的EDTA物质的量为0.0003 mol,故0.5400 g硫酸铝晶体中含铝物质的量为0.0003×10 mol,质量为0.0003 mol× 27 g·mol1×10=0.081 g,故ω(Al)=![]() ×100%=15%。
×100%=15%。


科目:高中化学 来源: 题型:
【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:________________________________________________________________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH________(填“>”、“=”或“<”)0。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,4 min达到平衡时测得c(CO)=0.2 mol·L-1,此时的温度为_____,则反应速率v(H2)=__________。
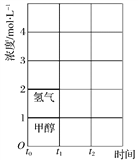
(3)T ℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的![]() ,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。__________
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。__________
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应 A(g)+ 3B(g)2C(g)达到平衡的标志是
A.C 的生成速率与 B 的生成速率相等
B.单位时间生成 nmolA,同时生成 3nmolB
C.A、B、C 的浓度不再变化
D.A、B、C 的分子数比为 1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚β羟丁酸作为一种天然高分子聚合物,具有生物相容性、生物可降解性、无免疫原性和组织相容性等特殊功能,在药物缓释控释系统、骨科以及医用手术缝合线领域有广泛的应用。以A为原料合成聚β羟丁酸的路线如下图:

已知:①芳香环在钠和醇的液氨溶液中能够被还原成1,4环己二烯;
② ;
;
③![]() 。
。
回答下列问题:
(1)A的分子式是__________。下列关于芳香烃的结构与性质的说法正确的是_______(填标号)。
a.芳香烃均含苯环,含苯环的有机物均为芳香烃
b.芳香烃均能发生加成反应
c.芳香烃都不能使酸性KMnO4溶液褪色
d.部分芳香烃能使溴的CCl4溶液褪色
(2)D的化学名称是_________。
(3)B结构简式是_________,C中含有的官能团是__________________。
(4)D生成E的化学方程式是___________________________,该反应的反应类型是_________。
(5)试剂X的同分异构体满足下列条件的共有_________种(不含立体异构)。
①遇FeCl3溶液有显色反应;②能与NaHCO3反应放出CO2。
其中核磁共振氢谱显示为5组峰,且峰面积比为1∶1∶2∶2∶2的是___________(写结构简式)。
(6)参照上述合成路线,以间二甲苯( )为原料(无机试剂任选),设计环酯
)为原料(无机试剂任选),设计环酯 的合成路线:____________________________________。
的合成路线:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置不能达到有关实验目的是
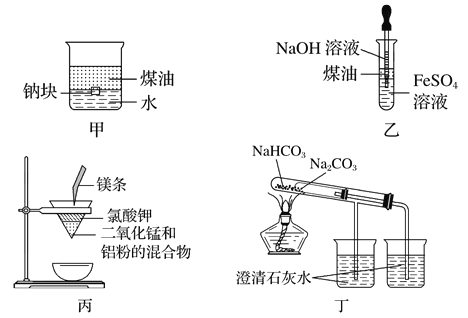
A. 用甲图装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰
D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某有机物由C、H、O三种元素组成,球棍模型如图所示:

(1)该有机物的分子式是_____________;
(2)该有机物可以发生加聚反应,其产物的结构简式是_____________;
(3)下列有关该有机物的描述中,正确的是____(填序号)。
a. 能与NaHCO3溶液反应
b. 能发生水解反应
c. 不能与溴的CCl4溶液反应
d. 能与酸性高锰酸钾溶液反应
II. (1)写出下列化合物的名称或结构简式:
①![]() _______________________________,
_______________________________,
②2,5-二甲基-2,4-己二烯的结构简式:_______________________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如图:

麻黄素中含氧官能团的名称是_________________,属于____________类(填“醇”或“酚”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法不正确的是( )
A. 目前我国流通的硬币是由合金材料制造的
B. 所有合金材料那具有较强的抗腐蚀能力
C. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
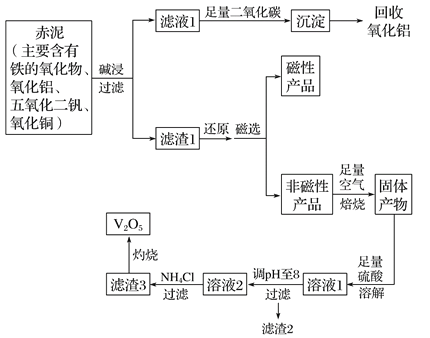
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,沉淀减少到4.66g,并有气体产生。
(1)写出有关离子方程式 。
(2)原混合物溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(3)产生的气体在标准状况下的体积是多少升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com