
【题目】聚β羟丁酸作为一种天然高分子聚合物,具有生物相容性、生物可降解性、无免疫原性和组织相容性等特殊功能,在药物缓释控释系统、骨科以及医用手术缝合线领域有广泛的应用。以A为原料合成聚β羟丁酸的路线如下图:

已知:①芳香环在钠和醇的液氨溶液中能够被还原成1,4环己二烯;
② ;
;
③![]() 。
。
回答下列问题:
(1)A的分子式是__________。下列关于芳香烃的结构与性质的说法正确的是_______(填标号)。
a.芳香烃均含苯环,含苯环的有机物均为芳香烃
b.芳香烃均能发生加成反应
c.芳香烃都不能使酸性KMnO4溶液褪色
d.部分芳香烃能使溴的CCl4溶液褪色
(2)D的化学名称是_________。
(3)B结构简式是_________,C中含有的官能团是__________________。
(4)D生成E的化学方程式是___________________________,该反应的反应类型是_________。
(5)试剂X的同分异构体满足下列条件的共有_________种(不含立体异构)。
①遇FeCl3溶液有显色反应;②能与NaHCO3反应放出CO2。
其中核磁共振氢谱显示为5组峰,且峰面积比为1∶1∶2∶2∶2的是___________(写结构简式)。
(6)参照上述合成路线,以间二甲苯( )为原料(无机试剂任选),设计环酯
)为原料(无机试剂任选),设计环酯 的合成路线:____________________________________。
的合成路线:____________________________________。
【答案】(1)C7H8(1分) bd(2分)
(2)丙二酸(1分)
(3)CH3COCH2COOH(1分) 羟基、羧基(1分)
(4)HOOCCH2COOH+2CH3CH2OH![]() CH3CH2OOCCH2COOCH2CH3+2H2O(2分) 酯化反应或取代反应(1分)
CH3CH2OOCCH2COOCH2CH3+2H2O(2分) 酯化反应或取代反应(1分)
(5)13(2分) 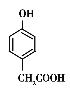 (1分)
(1分)
(6)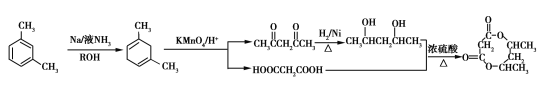 (3分)
(3分)
【解析】(1)根据已知信息①及框图中的生成物为![]() 可推知A为甲苯,其分子式为C7H8。芳香烃的衍生物含苯环,但不是芳香烃,a错误;一定条件下,苯环能与氢气发生加成反应,b正确;甲苯、乙苯等能被酸性KMnO4溶液氧化,c错误;苯乙烯能与Br2发生加成反应,d正确。
可推知A为甲苯,其分子式为C7H8。芳香烃的衍生物含苯环,但不是芳香烃,a错误;一定条件下,苯环能与氢气发生加成反应,b正确;甲苯、乙苯等能被酸性KMnO4溶液氧化,c错误;苯乙烯能与Br2发生加成反应,d正确。
(2)碳碳双键能被酸性高锰酸钾氧化为羧酸或酮,根据反应物为![]() ,由F逆推可知D为HOOCCH2COOH,其名称是丙二酸。
,由F逆推可知D为HOOCCH2COOH,其名称是丙二酸。
(3)由聚β羟丁酸逆推,结合![]() 在酸性高锰酸钾溶液中的反应可知B为CH3COCH2COOH;根据B生成C的条件为“H2/Ni”和加热可知该反应为加成反应,故C为CH3CHOHCH2COOH,含有羟基和羧基两种官能团。
在酸性高锰酸钾溶液中的反应可知B为CH3COCH2COOH;根据B生成C的条件为“H2/Ni”和加热可知该反应为加成反应,故C为CH3CHOHCH2COOH,含有羟基和羧基两种官能团。
(4)D生成E为酯化反应,故E为CH3CH2OOCCH2COOCH2CH3。
(5)结合E、F的结构简式及信息②可推知试剂X为![]() ,遇FeCl3溶液有显色反应说明结构中含有苯环及酚羟基,能与NaHCO3反应放出CO2说明含有羧基,所以苯环上支链可分两组:—CH3、—OH、—COOH;—OH、—CH2COOH,前者在苯环上有10种组合方式,后者有邻间对3种组合方式,故共13种同分异构体。其中
,遇FeCl3溶液有显色反应说明结构中含有苯环及酚羟基,能与NaHCO3反应放出CO2说明含有羧基,所以苯环上支链可分两组:—CH3、—OH、—COOH;—OH、—CH2COOH,前者在苯环上有10种组合方式,后者有邻间对3种组合方式,故共13种同分异构体。其中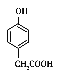 含有5种氢原子。
含有5种氢原子。
(6)合成路线为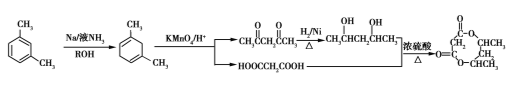 。
。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 石灰乳与过量碳酸氢钙溶液反应:HCO+Ca2++OH-===CaCO3↓+H2O
B. 向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:
FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C. 氢氧化铜与稀硫酸反应:H++OH-===H2O
D. 碳酸氢钠溶液中加入盐酸:CO32-+2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是
A. 15 B. 14 C. 13 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电离平衡常数(K)的说法中正确的是
A. 在一定温度,相同浓度时电离平衡常数(K)越大可以表示弱电解质电离程度越大
B. 电离平衡常数(K)与温度无关
C. 不同浓度的同一弱电解质,其电离平衡常数(K)不同
D. 多元弱酸各步电离平衡常数相互关系为K1<K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:
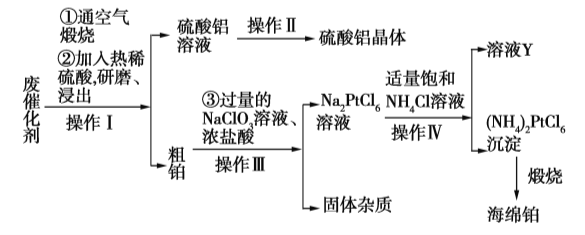
请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)写出第③步反应的离子方程式:_____________________________。
(4)此流程中的四个操作中有三个是相同的,其名称是__________,在实验室进行此操作使用的主要玻璃仪器有___________________。溶液Y中可以循环使用的物质是____________(填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下64 g S4和S8混合物中含有原子数为2NA
B. 标准状况下,22.4LHF中含电子数为10NA
C. 标准状况时,2.24LNO和1.12LO2于密闭容器中充分反应后,其分子数为0.1NA
D. 足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示
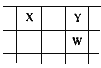
(1)五种元素形成的单质,其中固态时属于原子晶体的是________(填化学式);常用作强氧化剂的是________、________(填化学式)。
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,请用电子书表示该化合物中化学键的形成过程___________________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是______________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧放出140 kJ的热,写出该化合物燃烧热的热化学方程式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com