
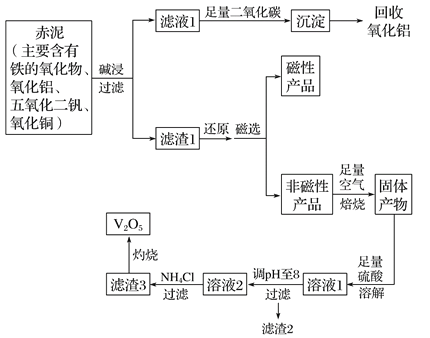
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
【答案】(1)a (2)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ (3)Fe (4)VO2+转化为VO3-
(5)NH4VO310Al+3V2O5![]() 5Al2O3+6V
5Al2O3+6V
【解析】试题分析:(1)氧化铝不能溶解在弱碱中,则选择强碱氢氧化钠,答案选a;
(2)滤液1中含有偏铝酸钠,与足量二氧化碳反应的离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓。
(3)铁不能溶解在氢氧化钠中,则滤渣1中含有铁,所以磁选步骤得到的磁性产品为铁;
(4)由于NH4VO3难溶,所以溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使VO2+转化为VO3-。
(5)由于NH4VO3难溶,所以滤渣3的主要成分为NH4VO3,根据电子得失守恒和原子守恒可知钙铝热反应的方程式为10Al+3V2O5![]() 5Al2O3+6V。
5Al2O3+6V。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 石灰乳与过量碳酸氢钙溶液反应:HCO+Ca2++OH-===CaCO3↓+H2O
B. 向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:
FeCl3+3H2O(沸水)![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C. 氢氧化铜与稀硫酸反应:H++OH-===H2O
D. 碳酸氢钠溶液中加入盐酸:CO32-+2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
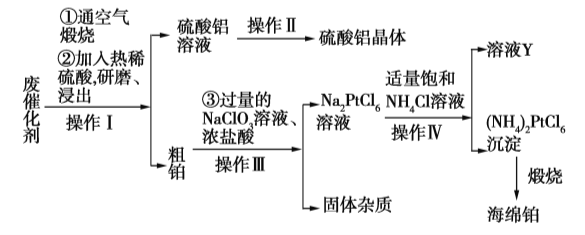
【题目】某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:
请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)写出第③步反应的离子方程式:_____________________________。
(4)此流程中的四个操作中有三个是相同的,其名称是__________,在实验室进行此操作使用的主要玻璃仪器有___________________。溶液Y中可以循环使用的物质是____________(填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下64 g S4和S8混合物中含有原子数为2NA
B. 标准状况下,22.4LHF中含电子数为10NA
C. 标准状况时,2.24LNO和1.12LO2于密闭容器中充分反应后,其分子数为0.1NA
D. 足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。

试回答下列问题:
⑴ A的化学式是____________;
⑵ 反应F→D的化学方程式是______________________________________。
⑶ 检验F中金属阳离子的常用方法是___________________________________。
⑷ 物质B与盐酸反应的离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中在同周期中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示
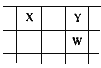
(1)五种元素形成的单质,其中固态时属于原子晶体的是________(填化学式);常用作强氧化剂的是________、________(填化学式)。
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序是________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,请用电子书表示该化合物中化学键的形成过程___________________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是______________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧放出140 kJ的热,写出该化合物燃烧热的热化学方程式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com