
【题目】下列物质中在一定条件下能够导电,但不属于电解质的是
A. 石墨 B. KNO3 C. H2SO4 D. 蔗糖
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
(1)肼(N2H4)是一种良好的火箭燃料,拉希格法是制备肼的传统方法,该方法是在5℃条件下,NaClO与NH3反应生成NH2Cl与NaOH,然后在140℃左右的条件下,将上述反应后混合物与氨混合,反应生成肼。上述两步反应中,氧化产物是______________(写化学式)。
(2)机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物。目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和水,涉及到的反应有:
CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) ΔH1=574 kJ·mol1
CH4(g)+2NO2(g)CO2(g)+2H2O(g)+N2(g) ΔH2=867 kJ·mol1
写出CH4还原NO生成N2的热化学方程式:____________________________。
(3)变质的蔬菜类食物中含有亚硝酸盐,一定温度下,形成该盐的亚硝酸(HNO2)的电离常数Ka=4.0×104。在20 mL 0.01 mol·L1的亚硝酸中逐滴滴加0.01 mol·L1的NaOH溶液,测得混合液的pH变化如图,则图中a点的值为______,b点溶液呈酸性,其原因是__________________,d点溶液呈碱性,原因是______________________________。(已知lg2≈0.3)

(4)工业合成氨的反应原理为:N2(g)+ 3H2 (g)![]() 2NH3(g) ΔH=a kJ·mol1。保持反应体系的容积不变,在其中加入一定量的H2和N2,体系中各物质浓度随时间变化如图所示:
2NH3(g) ΔH=a kJ·mol1。保持反应体系的容积不变,在其中加入一定量的H2和N2,体系中各物质浓度随时间变化如图所示:

①若上述反应体系的容积为2 L,则0~20 min时间内,ν(H2)= ______________,该过程中放出的热量为94.4 kJ,则a=______________。
②25 min时将NH3从反应体系中完全分离出去,45 min时改变温度,在原图中画出25 min~60 min的NH3浓度变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置不能达到有关实验目的是
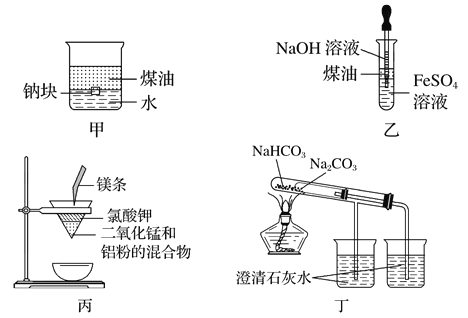
A. 用甲图装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰
D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其合金的说法不正确的是( )
A. 目前我国流通的硬币是由合金材料制造的
B. 所有合金材料那具有较强的抗腐蚀能力
C. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下某溶液中由水电离产生的[H+]=1×10-5mol·L-1,则下列叙述正确的是
A. 一定是碱溶液
B. 一定是酸溶液
C. 由水电离出的[OH-]=1×10-9mol·L-1
D. pH值可能为9也可能为5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
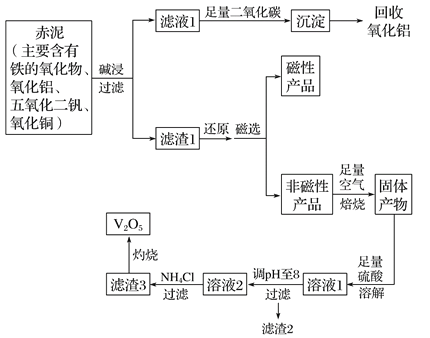
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是3种物质的溶解度(20℃),下列说法中不正确的是
物 质 | MgCl2 | Mg(OH)2 | MgCO3 |
溶解度(g/100g) | 74 | 0.00084 | 0.01 |
A. 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
B. 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH溶液
C. 已知MgCO3的Ksp=6.82×10-6mol2/L2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)×c(CO32-)=6.82×10-6mol2/L2
D. 用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:
Mg2++2HCO3-+2Ca2++4OH-===2CaCO3↓+Mg(OH)2↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式_________________________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“>”或“<”)
(3)AsCl3分子的立体构型为______________,其中As的杂化轨道类型为__________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_____________。(已知:晶胞内As原子之间彼此不相切)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:
2FeCl3+Cu![]() 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
A. 残余固体全部是Cu
B. 残余固体可能为Fe和Cu的混合物
C. 最后得到的溶液可能含有Fe3+
D. 残余固体是Fe,溶液中一定不含Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com