
����Ŀ����ѧ�����ڻ�ѧ��ռ����Ҫ��λ����ش��������⣺
��1������mgij���壬����˫ԭ�ӷ��ӹ��ɣ���Ħ������ΪM gmol��1 �� �������ӵ�������NA��ʾ����
�ٸ���������ԭ������Ϊ�� ���������ú���NA��ʽ�ӱ�ʾ��
�ڸ���������ˮ����������ˮ��Ӧ�����γ�V L��Һ������Һ�����ʵ���Ũ��Ϊ
��2����һ�����¶Ⱥ�ѹǿ�£�1�������X2��3�������Y2��������2����������û�����Ļ�ѧʽ��
��3��ij�λ����Һ�к���Na+��Mg2+��Cl����SO42�� �� ���Na+��Mg2+��Cl�������ʵ���Ũ������Ϊ��0.2mol
L��1��0.25molL��1��0.4molL��1 �� ��c��SO42����=��
���𰸡�
��1��![]() ��
��![]() mol/L
mol/L
��2��XY3��Y3X
��3��0.15 mol?L��1
����������1����mg����������ʵ���Ϊ��![]() =
=![]() mol��������Ϊ˫ԭ�ӷ��ӣ����е�ԭ����Ϊ��
mol��������Ϊ˫ԭ�ӷ��ӣ����е�ԭ����Ϊ��![]() mol��2��NA=
mol��2��NA=![]() mol��
mol��
���Դ��ǣ�![]() ��
��
��������Һ�����ʵ���Ũ��Ϊ��![]() =
=![]() mol/L��
mol/L��
���Դ��ǣ�![]() mol/L��
mol/L��
��2��һ���¶Ⱥ�ѹǿ�£�1���X2������3���Y2���廯������2������廯�����û�����ΪZ������������֮�ȵ������ʵ���֮�ȣ����ڻ�ѧ������֮�ȣ�
��X2+3Y2�T2Z����ԭ���غ��֪��ZΪXY3��Y3X��
���Դ��ǣ�XY3��Y3X��
��3�����ݵ���غ�ɵã�c��Na+��+2c��Mg2+��=c��Cl����+2c��SO42������
��0.2molL��1+2��0.25molL��1=0.4molL��1+2c��SO42������
��ã�c��SO42����=0.15 molL��1
���Դ��ǣ�0.15 molL��1 ��


 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и��������У��ܴ�������ģ� ��
A.Ag+��NO3����Na+��Cl��
B.K+��HCO3����Cl����Al3+
C.NO3����Fe2+��H+��Br��
D.K+��Cl����SO42����NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�м����߱�ʾ�������¶��£�ij��ø�ٷ�Ӧ�����뷴Ӧ��Ũ��֮��Ĺ�ϵ�������������߷ֱ��ʾ��ø�ٷ�Ӧ�ķ�Ӧ�������¶Ⱥ�pH��Ӱ��������ش��������⣺

��1���������У�����A���ʵ�����¶ȣ���Ӧ���ʽ���_____________________����B���ʵ�����ø��Ũ�ȣ���Ӧ���ʽ���__________________��
��2���������У�H�������ø��_____________________��
��3������Ҫ���ڱ����ø��Ӧѡ�������е�________������Ӧ���¶ȡ�
��4��̽���¶ȶ�ø���Ե�Ӱ��ʱ��ͨ��ѡ��_________________________�������ø����������ø������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һѧ�����������ʵ�鷽������NaCl��CaCl2���ֹ������� 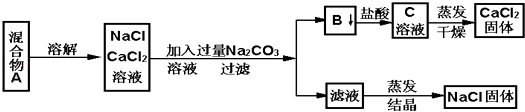 ��պͻش���������
��պͻش���������
��1��B��������д��ѧʽ��
��2������ʵ�鷽������õ���NaCl���������������ʣ�����Ϊ����������ijһ�������ë������һ������ȷ��Ʒ���Ӧ�� ��
��3����Ҫ�ⶨ����Ʒ��NaCl��CaCl2�������ȣ��ɳ��������B���ʺ���һ���ʵ����������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCO3��ɰ�ǻ��ÿ�������Ѫ����ʵ�������Ʊ�FeCO3��������ͼ��ʾ������˵��������ǣ� �� 
A.��ƷFeCO3�ڿ����и��·ֽ�ɵõ�������FeO
B.������KSCN��Һ����FeSO4��Һ�Ƿ����
C.������������CO2����ų�
D.��������Ƿ�ϴ�Ӹɾ����������ữ��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һЩ�������ص�ʳ���У�����������ҵ���ε���ʳ���ζ������ж��������εĻ�ѧʽΪ�� ��
A. MgCl2B. KClC. NaNO2D. MgSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ˮ�к�KCN����Ũ��Ϊ0.01molL��1 �� �������������������������·�Ӧ����������N���ϼ۾�Ϊ��3�ۣ���
��1��KCN+2KOH+Cl2�TKOCN+2KCl+H2O��������Ԫ���� �� ����Ԫ�ط��ű�ʾ��
��2��Ͷ�����Һ�ȣ��ɽ������ν�һ������Ϊ����������ƽ���л�ѧ����ʽ��
KOCN+Cl2+�TK2CO3+N2+KCl+ ��
��3������10L��KCN��Ũ��Ϊ0.01molL��1�ķ�ˮ��KCN������ȥ��������Ҫ����mol��
��4��ijʵ��С��Ϊ�˲ⶨ��3������Һ����Cl2�ĺ���������Na2S2O3����Һ���ж����ⶨ����ʵ��������480mLһ��Ũ�ȵ�Na2S2O3��Һ�����Ƹ���Һ���貣���������ձ�����Ͳ������������ͷ�ι��⣬����
��5��Na2S2O3��ԭ�Խ�ǿ������Һ���ױ�Cl2������SO42�� �� ���Na2S2O3���������ȼ����÷�Ӧ�����ӷ���ʽΪ ��
��6����ȡ��3������Һ20.00mL����amolL��1 Na2S2O3��Һ���еζ�������ƽ��ʵ��������Na2S2O3����Һb mL�������Һ��Cl2��Ũ��ΪmolL��1 ���ú�a��b�ı���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пԭ����У�������ͭΪ�������Һ��пΪ�����缫�Ϸ���������Ӧ������������ԭ�������缫��ӦʽΪ �� пƬ�Ϲ۲쵽������Ϊ�����缫�ϵĵ缫��Ӧʽ�� �� ��Ƭ�Ϲ۲쵽�������� �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����﮵�ص����С�������������dz��õ�һ�ε�أ��õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4���ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2 �� �ش��������⣺ 
��1�����·�ĵ�������������������������ĸ����
��2�����������Ӧʽ ��
��3���Ƿ����ˮ�������еĻ���л��ܼ�������ǡ�����ԭ���� ��
��4��MnO2����KOH��KClO3�ڸ����·�Ӧ������K2MnO4 �� ��Ӧ�Ļ�ѧ����ʽΪ �� K2MnO4��������Һ���绯������KMnO4��MnO2�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com