
Ϊ��˵��������������ʣ�ijͬѧ���������ʵ�鷽��֤�������д������
| A������0.10 mol/L CH3COOH��Һ������Һ��pH����pH����1�����֤������Ϊ������� |
| B����pH�Ʒֱ��0.01 mol/L��0.10 mol/L�Ĵ�����Һ��pH�������ߵ�pH���С��1����λ�����֤��������������� |
| C��������ʹ�����Һ���е�����ʵ�飬����CH3COOH��Һ�മ���ĵ��ݽϰ���֤������Ϊ������� |
| D������0.10 mol/L CH3COONa��Һ������pH����������pH����7�����֤��������������� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������ȷ����
A��0��1 mol��L��ˮ�У�c��OH������c(NH4+)
B����������ʵ���Ũ�Ⱦ���ͬ��ϡH2SO4��NaOH��Һ��ֻ�Ϻ���Һ��pH��7
C����0.1mol��L CH3COONa��Һ�У�c��OH������c��CH3COOH����c��H����
D��0��1mol��Lij��Ԫ����ǿ����NaHA��Һ�У�c��Na������2c��A2������c��HA������c��H2A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���pH=12��ij��Һ�У���ˮ�����c(OH��)����Ϊ
��1.0��10-7mol/L ��1.0��10-6mol/L ��1.0��10-2mol/L ��1.0��10-12mol/L
| A���٢� | B���ۢ� | C���� | D���ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£��йآ�pH=2��CH3COOH��Һ����pH=2��HCl��Һ����pH=12�İ�ˮ����pH=12��NaOH��Һ��������Һ�ıȽ��У���ȷ����
| A��ˮ�����c(H��)����=��=��=�� |
| B�����ڡ�����Һ��Ϻ�pH=7����������Һ���������=�� |
| C��������Ģ١��ڡ�����Һ�ֱ����������۷�Ӧ������H2����������� |
| D������Һ�м���100mLˮ����Һ��pH���ۣ��ܣ��٣��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�������£�Na2CO3��Һ�д���ƽ��CO32-��H2O HCO3-��OH��������˵���������
HCO3-��OH��������˵���������
A��ϡ����Һ�� ���� ���� |
| B��ͨ��CO2����ҺpH��С |
| C�������¶ȣ�c(CO32-)��С |
D������NaOH���壬 ��С ��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����Һ�������25�棬�й�������ȷ����
| A��ij���ʵ���ҺpH��7�������Һ�м�������������Һ��Kw���� |
| B��pH��8��NaOH��Һϡ��100������pH��6 |
| C����1L 0.1mol��L��1��Ba(OH)2��Һϡ��Ϊ2L��pH��12 |
| D��pH��4.5�ķ���֭��c(H��)��pH��6.5��ţ����c(H��)��100�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ij�¶�ʱ����ô�ˮ�е�c(H��)��2.4��10��7mol/L����c(OH��)Ϊ
| A��2.4��10��7mol/L | B��0.1��10��7mol/L |
C��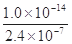 mol/L mol/L | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ʱ����1��0mol/L NaOH��Һ�к�ijŨ��������Һʱ����pH ������NaOH��Һ�������ϵ��ͼ��ʾ��ԭ������Һ�����ʵ���Ũ�Ⱥ���ȫ��Ӧ����Һ���������
| A��1 mol/L 60mL | B��0��5 mol/L80mL |
| C��0��5 mol/L40mL | D��1 mol/L80mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ���¶��µ����ܵ����AmBn��ˮ��Һ�дﵽ�ܽ�ƽ��ʱ����֪�±�����
| ���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25�� | 8.0��10-16 | 2.2��10-20 | 4.0��10-38 |
| ��ȫ����ʱ��PHֵ | ��9.6 | ��6.4 | 3��4 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com