
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC[Al2(OH)nCl6-n]的流程如下: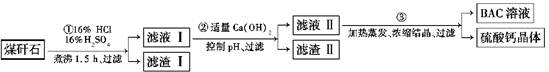
(1)粉碎煤矸石的目的是__________________________________________________;
滤渣Ⅰ的主要成分是________(填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中的有色离子为_____
________(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为_________;步骤①的煮沸装置上方需安装一长导管,长导管的作用是__________________________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是________
_______________________;已知BAC的分散质粒子大小在1~100 nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式:_______________________
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式:____________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
| A.Cl2 | B.H2O2 | C.ClO2 | D.O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钛有强度高和质地轻的优点,广泛应用于飞机制造业等。工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下: 已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等。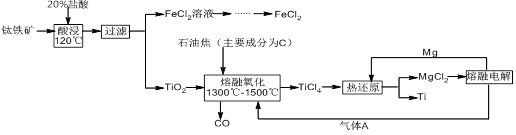
(1)请写出FeTiO3与稀盐酸反应的离子方程式: 。
(2)请写出“熔融氧化”的化学方程式: 。
(3)电解氯化镁的阴极反应式为: ,可循环利用的物质为: (填化学式)。
(4)热还原法中能否改用钠代替镁作还原剂: (填“能”或“不能”);原因为: 。
(5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
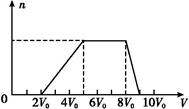
| Cl2的体积(标准状况) | 11.2 L | 22.4 L | 28.0 L |
| n(Cl-) | 2.5 mol | 3.5 mol | 4.0 mol |
| n(Br-) | 3.0 mol | 2.5 mol | 2.0 mol |
| n(I-) | x mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将NaOH溶液滴入FeSO4溶液中,能观察到的现象是 。
(2)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。
则Fe粉和氯化铁的物质的量之比为________
(3)向40mL 1mol/L的NaOH溶液中通入过量的CO2,并将溶液分成两等份。
①一份加热、蒸干、灼烧,所得固体的化学式是 。
②将NaHSO4固体放入另一份溶液中,发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某厂废水中含5.00×10-3 mol·L-1的Cr2O,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: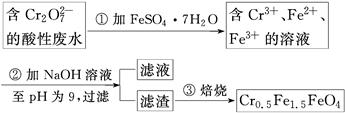
(1)第①步反应的离子方程式是________________________________________________。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________。
(3)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图: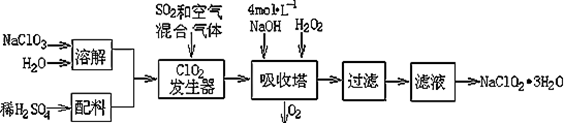
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O ;
②Ksp(FeS)=6.3×10-18 ; Ksp(CuS)=6.3×10-36 ;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为 。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为 g。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a蒸馏;b灼烧;c过滤;d冷却结晶;e蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。
下表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka/mol?L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10?8 K2=1.1×10?12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)含氯消毒剂可防甲型H1N1流感。二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得。请写出反应的离子方程式_____________________________________________________________________________。
(2)某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、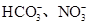 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有_______,一定不会含有大量的_______。
②该溶液与Al2O3反应后有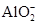 生成,则原溶液中一定含有_______,可能含有大量的_______。
生成,则原溶液中一定含有_______,可能含有大量的_______。
③写出该溶液与Al2O3反应生成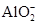 的离子方程式____________________________。
的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某混合溶液中可能大量含有的离子如下表所示:
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com