
钛有强度高和质地轻的优点,广泛应用于飞机制造业等。工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下: 已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等。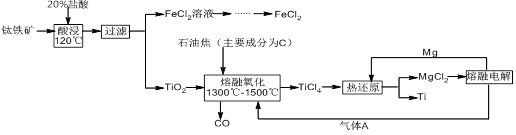
(1)请写出FeTiO3与稀盐酸反应的离子方程式: 。
(2)请写出“熔融氧化”的化学方程式: 。
(3)电解氯化镁的阴极反应式为: ,可循环利用的物质为: (填化学式)。
(4)热还原法中能否改用钠代替镁作还原剂: (填“能”或“不能”);原因为: 。
(5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是 (填化学式)。
(1)FeTiO3+2H+  Fe2++TiO2+H2O (3分)
Fe2++TiO2+H2O (3分)
(2)TiO2+ 2C+ 2Cl2  TiCl4+ 2CO (3分)
TiCl4+ 2CO (3分)
(3)Mg2+ + 2e- =" Mg" (3分) Cl2和Mg (2分)
(4)能;(1分)钠的还原性比镁强(1分)
(5)HCl(2分)(填写H2SO4、HNO3均可)
解析试题分析:由已知条件可知,金属Ti是难溶于稀硫酸和稀盐酸的物质,而杂质MgCl2和Mg都是易溶于酸的,所以要除去杂质,可以加入稀盐酸或稀硫酸等试剂。
(1)根据流程图示,钛铁矿中加入盐酸酸浸后,得到了滤液氯化亚铁和滤渣TiO2,所以根据反应物和产物可以写出反应的离子方程式为:FeTiO3+2H+  Fe2++TiO2+H2O。
Fe2++TiO2+H2O。
(2)熔融氧化过程中参与反应的物质已知的有TiO2和C,从产物来看C作了还原剂被氧化成了CO,但是TiO2生成TiCl4,Ti的化合价没有发生变化,且多出了Cl离子,所以由此可以猜测还有一种氧化剂参与了反应,而氧化剂就是氯气,所以根据所推反应物和生成物,该反应的化学方程式为:TiO2+ 2C+ 2Cl2  TiCl4+ 2CO。
TiCl4+ 2CO。
(3)电解氯化镁可以制备金属镁,所以阴极发生的反应式为Mg2+ + 2e- = Mg,而阳极发生氧化反应生成氯气,电解产生的金属镁、氯气可以分别在热还原步骤和熔融氧化步骤中加以循环利用。
(4)热还原是在高温的条件下用活泼金属还原制备较不活泼金属的过程,金属钠比金属镁更加活泼,所以也可以用金属钠代替金属镁做还原剂。
考点:本题考查的是比较基础的化学工艺流程题。


科目:高中化学 来源: 题型:填空题
(16分)实验室中以粗铜(含杂质)为原料,某种制备铜的氯化物的流程如下:
按要求回答下列问题:
(1)操作①的所用到的玻璃仪器有______________。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
A.NaOH B.NH3·H2O C.CuO D.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式: 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。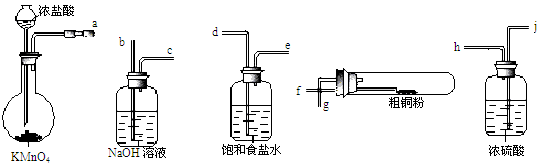
①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验中大试管加热前要进行一步重要操作,其操作是 。
②反应时,盛粗铜粉的试管中的现象是 。
(5)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) + 4Cl-(aq)  CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 (填序号)。
A.将Y稀释,发现溶液呈蓝色 B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色 D.取Y进行电解,溶液颜色最终消失
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据要求填空。
(1)下列物质中,属于电解质的是 ,属于非电解质的是 。(填序号)
①碳酸氢钠 ②CO2 ③乙醇 ④铁
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为如下:
10 Al + 6 NaNO3 + 4 NaOH +18 H2O =" 10" NaAl(OH)4 + 3 N2↑
请用“单线桥法”表示上述反应中电子转移的方向和数目。
(3)已知氨气与氯气在常温条件下发生如下反应:8 NH3+3 Cl2= 6 NH4Cl +N2,该反应中还原剂与氧化剂的物质的量之比为 。
(4)今有K2SO4和Al2(SO4)3混合溶液,已知其中c(K+)=" 0.2" mol·L-1,c(SO42-)= 0.7mol·L-1。则溶液中c(Al3+)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g) ⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) △H=" -44.0" kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
浓度/mol·L-1
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
 N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有S2-、NH4+、Na+、(SO4)2-、Fe3、ClO-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是__________。
(2)在水溶液中,该离子水解呈酸性的是_________。
(3)不能在酸性较强的溶液里大量存在的离子有_________。
(4)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、ClO-、ClO3—三种含氯元素的离子,其中ClO-、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。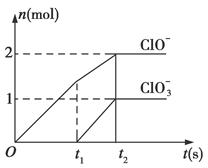
(1)t1前,氧化产物是______________________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式:_____________________________。
(3)该石灰乳中含有Ca(OH)2的物质的量是________mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是________(填字母)。
| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC[Al2(OH)nCl6-n]的流程如下: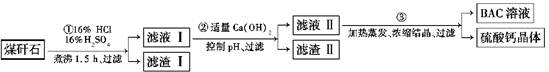
(1)粉碎煤矸石的目的是__________________________________________________;
滤渣Ⅰ的主要成分是________(填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中的有色离子为_____
________(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为_________;步骤①的煮沸装置上方需安装一长导管,长导管的作用是__________________________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是________
_______________________;已知BAC的分散质粒子大小在1~100 nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式:_______________________
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某强酸性溶液X含有Ba2+、Al3+、N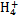 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C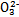 、S
、S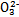 、S
、S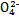 、Cl-、N
、Cl-、N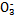 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下: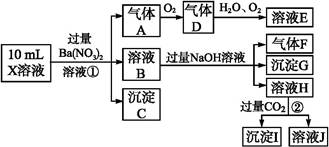
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)="0.04" mol,而沉淀C物质的量0.07 mol,能说明(1)中不能确定的阴离子存在的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com