
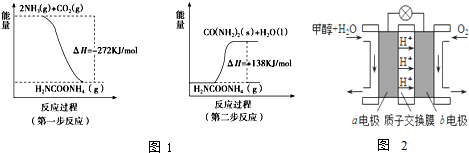
| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| ||
| △t |
| c(CO) |
| c(CO 2) |
| x |
| 4-x |
| 2mol |
| 4mol |
| ||
| 5min |
| c(CO) |
| c(CO 2) |
| 0.56 |
| 22.4 |
| 0.1 |
| 1 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、
| ||
| B、a mol?L-1 | ||
| C、2a mol?L-1 | ||
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子从负极经外电路流向正极 |
| B、在原电池中,负极上发生还原化反应 |
| C、原电池工作时,溶液中的阳离子向负极移动 |
| D、构成原电池的正极和负极必须是两种不同的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 | |||
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为 N2(g)+3H2(g)
| |||
C、已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+
| |||
| D、25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ?mol-1,硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-114.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素C在周期表中的位置是第三周期第ⅤA族 |
| B、在等体积、等pH的X、Y溶液中分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X<Y |
| C、由A、B、C、D四种元素形成的化合物一定只有共价键 |
| D、25℃时,将W溶液与Y溶液等体积混合,充分反应后若pH=7则c(W)>c(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| W | Z | ||
| T |
| A、X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B、由X、Y和氢三种元素形成的化合物中一定只有共价键 |
| C、W、X、Z三种元素最高价氧化物对应水化物的酸性逐渐减弱 |
| D、T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
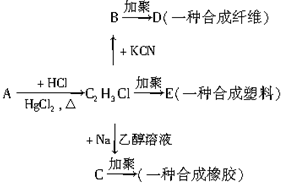 卤代烃里的卤原子易与活泼金属阳离子结合,发生下列反应:
卤代烃里的卤原子易与活泼金属阳离子结合,发生下列反应:| 乙醇 |
| 乙醇溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在碳酸氢钠溶液中加入过量的氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B、向明矾溶液中加入少量的Ba(OH)2溶液:Al3++3OH-+Ba2++SO42-=BaSO4↓+Al(OH)3↓ |
| C、向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ |
| D、向含有1molFeBr2溶液中通入标准状况下22.4L的Cl2:2Br-+Cl2=Br2+2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com