
����Ŀ���±���Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����һ��Ԫ�أ�NAΪ�����ӵ�������ֵ���� 
��1��Ԫ��Bλ��Ԫ�����ڱ������s������p����d��������
��2����A��X��K����Ԫ���е�ij�����γɵĻ������У�ÿ��ԭ�Ӷ����������Ϊ8�����ȶ��ṹ��������
�������ʽ����
��3��ֻ��A��E��������Ԫ�صľ�����г����ԣ������ͳ��������һ��������ͼ��ʾ���þ���Ļ�ѧʽΪ ��
��4��Ԫ��D��K�γɵĻ������У�ÿ����������Χ�����������ȵ����������������û����ᄃ����ܶ�Ϊa g/cm3 �� ���������cm3 �� 
���𰸡�
��1��p
��2��CCl4��PCl3
��3��MgCNi3
��4��12��![]()
���������⣺AΪ̼Ԫ�أ�BΪ��Ԫ�أ�DΪ��Ԫ�أ�E��þԪ�أ�FΪ��Ԫ�أ�XΪ��Ԫ�أ�KΪ��Ԫ�أ�MΪ��Ԫ�أ���1����ԭ�ӵĵ����Ų�ʽ��1s22s22p6 �� ������p���ӣ�������ԭ��λ��p�������Դ��ǣ�p������2����C��P��Cl�е�ij�����γɵĻ������У�ÿ��ԭ�Ӷ����������Ϊ8�����ȶ��ṹ��������CCl4��PCl3�����Դ��ǣ�CCl4��PCl3����3��̼ԭ��λ�ڸþ����������ϣ����Ըþ����к���һ��̼ԭ�ӣ�þԭ�Ӹ���=8�� ![]() =1�����Ըþ�������1��þԭ�ӣ���ԭ�Ӹ���=6��
=1�����Ըþ�������1��þԭ�ӣ���ԭ�Ӹ���=6�� ![]() =3���þ����к���3����ԭ�ӣ����Ըþ����Ļ�ѧʽΪMgCNi3�����Դ��ǣ�MgCNi3����4����֪�Ȼ��Ƶľ���ͼΪ
=3���þ����к���3����ԭ�ӣ����Ըþ����Ļ�ѧʽΪMgCNi3�����Դ��ǣ�MgCNi3����4����֪�Ȼ��Ƶľ���ͼΪ 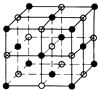 ��������ÿ��Na+��Χ�����������ȵ�Na+����12�����þ����������Ӹ���=1+12��
��������ÿ��Na+��Χ�����������ȵ�Na+����12�����þ����������Ӹ���=1+12�� ![]() =4�������Ӹ���=8��
=4�������Ӹ���=8�� ![]() +6��
+6�� ![]() =4������1���Ȼ��ƾ����к���4���Ȼ��ƣ����������V=
=4������1���Ȼ��ƾ����к���4���Ȼ��ƣ����������V= ![]() =
= ![]() cm3�����Դ��ǣ�12��
cm3�����Դ��ǣ�12�� ![]() ��
��


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯������о�������ѧ�ķ�չ��ռ�ж��صĵ�λ��
��1����Ԫ����10B��11B������Ȼ�ȶ�ͬλ�أ��ڻ�̬11Bԭ���У��۵����д���______�����������෴�ĵ��ӡ���һ�����ܽ���B��N֮��ĵڶ�����Ԫ����______�֡�
��2��Ŀǰ���Ƶö�ʮ�������⻯�����������B2H6��������B4H10������Դ����ǰ�����ڡ�
��NH3��ͨ����λ������Ԫ�ص�ij���⻯�����õõ�������M, M��һ���µĴ�����ϣ�����M �Ỻ���ͷų�H2����ת��Ϊ������N, M��N�ֱ������顢��ϩ�ĵȵ����塣M�ĽṹʽΪ______������λ��������ԭ����M��N�����е��ӻ���ʽ�ֱ�Ϊ_________��
��B2H6�������ȼ�ϣ���B2H6����ͨ��H2O�еķ�ӦΪB2H6��6H20=2H3BO3+6H2�����ݴ˿��жϷ�Ӧ�����漰Ԫ�صĵ縺�Դ�С��˳��Ϊ_________��
��������(H3BO3)Ϊԭ�Ͽ��Ƶ����⻯��(NaBH4)�������л��ϳ��е���Ҫ��ԭ�����ɽ�����ֱ�ӻ�ԭ�ɴ���
CH3C00H ![]() CH3CH2OH
CH3CH2OH 
��ͼ��������Ӽ���1������2����ԭ��Ϊ_____________��
��3������(BP)���ܸ߶ȹ�ע����ĥ���ϣ�����Ϊ��������ı����㣬��ṹ����ʯ���ƣ���ͼ1��ʾ��

��ͼII��������Z���ͶӰͼ������ͼII��Բ����Ϳ��![]() ���ͻ��������ֱ����B��P�����λ��_____________��
���ͻ��������ֱ����B��P�����λ��_____________��
����֪�����߳�Ϊapm����������ܶ���______g/cm3��ֻҪ������ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ģ�ͷֱ��ʾC2H2��S8��SF6�Ľṹ������˵��������ǣ� �� 
A.32 g S8�����к���0.125 mol �Ҽ�
B.SF6���ɼ��Լ����ɵķǼ��Է���
C.1 mol C2H2��������3 mol �Ҽ���2 mol �м�
D.1 mol S8���8 mol S��S��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ涨��Χ��ʹ��ʳƷ���Ӽ���һ����Ϊ�����彡���������Υ���涨�����������彡�����������ʿ�����ʳƷ���������ǣ�������
A.��ȩ
B.����E
C.������
D.�����ἰ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ��������ϩ�İ취�ǣ� ��
A.��ȼB.��������Ӧ
C.ͨ�����Ը��������ҺD.ͨ����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��̽��SO2��Fe(NO3)3��Һ�ķ�Ӧ���䷴Ӧװ������ͼ��ʾ��
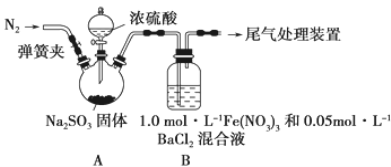
��֪��1.0 mol��L��1��Fe(NO3)3��Һ��pH��1����c(H+)=0.1 mol��L��1�����ش��������⣺
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽ��_____________________________________________
��2���μ�Ũ����֮ǰӦ���ɼ���װ����ͨ��һ��ʱ���N2��Ŀ����________________________________
��3��װ��B�в����˰�ɫ��������ɷ���___________��˵��SO2����___________�ԡ�
��4������B�в�����ɫ������ԭ��
����1��SO2��Fe3��������������NO3-����Ӧ��
����2��___________________��
����3��������������SO2��NO3����Ӧ��
�ٰ�����2��װ��B�з�Ӧ�����ӷ���ʽ�� _____________________________________��
�ڰ�����3��ֻ�轫װ��B�е�Fe(NO3)3��Һ�滻Ϊ�������������Һ������ͬ�����½���ʵ�顣Ӧѡ����Լ���________________������ĸ����
A��1.5 mol��L��1Fe(NO3)2��Һ
B��0.1 mol��L��1��������Һ
C��6.0 mol��L��1 NaNO3��0.2 mol��L��1����������ϵ���Һ
D��3.0 mol��L��1 NaNO3��0.1 mol��L��1����������ϵ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣����еĢ١�����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش�
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
�� | �� | �� | �� | |||||
�� | �� | �� | �� | �� | ||||
�� | �� |
��1������ЩԪ���У���ѧ��������õ�ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ___________��
��2����Ԫ�ص�ԭ��L����______�����ӣ������������Ļ�ѧʽΪ________����̬�⻯��Ļ�ѧʽΪ________��ʵ�����Ʊ�����̬�⻯��Ļ�ѧ����ʽΪ__________��
��3����ЩԪ�ص�����������Ӧ��ˮ�����У�������ǿ����_______��������ǿ����______�������Ե���__________________��
��5��д���ٵ����ڿ�����ȼ�յĻ�ѧ����ʽ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п���Ũ��������������(����)
��H2����SO2����H2S����Cl2����NH3����HCl����CO2����HBr����CO
A.�٢ڢܢޢ��B.�٢ڢܢޢߢ�
C.�٢ڢܢޢߢ�D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ָ���������£����и�������һ���ܴ���������ǣ�������
A.��ɫ����Һ�У�Fe3+��K+��NO3����Cl��
B.���д���Ba2+����Һ�У�NH4+��Na+��Cl����H+
C.pH=13����Һ�У�NH4+��Na+��SO42����Cl��
D.c��H+��=0.1 molL��1����Һ�У�K+��I����Cl����NO3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com