
【题目】某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如下图所示:
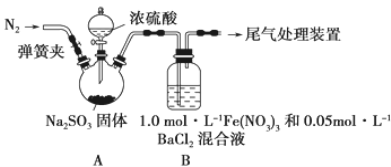
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1(即c(H+)=0.1 mol·L-1),回答下列问题:
(1)装置A中反应的化学方程式是_____________________________________________
(2)滴加浓硫酸之前应打开弹簧夹向装置中通入一段时间的N2,目的是________________________________
(3)装置B中产生了白色沉淀,其成分是___________,说明SO2具有___________性。
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:___________________;
猜想3:在酸性条件下SO2与NO3—反应;
①按猜想2,装置B中反应的离子方程式是 _____________________________________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________________(填字母)。
A.1.5 mol·L-1Fe(NO3)2溶液
B.0.1 mol·L-1硝酸钠溶液
C.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
D.3.0 mol·L-1 NaNO3和0.1 mol·L-1盐酸等体积混合的溶液
【答案】 Na2SO3+H2SO4(浓)= Na2SO4+SO2↑+H2O 排除空气对实验的干扰 BaSO4 还原 SO2与Fe3+反应 SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+ C
【解析】(1)装置A中是亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫和水,其反应的化学方程式是Na2SO3+H2SO4(浓)= Na2SO4+SO2↑+H2O;
(2)因为氧气能氧化Na2SO3,会对实验有影响,所以为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出。
(3)因为二氧化硫可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;所以装置B中产生了白色沉淀是硫酸钡沉淀;二氧化硫表现了还原性;
(4)综合猜想1、3可知猜想2:SO2与Fe3+反应;
①按猜想2,装置B中反应的离子方程式是;SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+
②按猜想3:在酸性条件SO2与NO3-发生氧化还原反应,只要溶液中硝酸根离子浓度不变即可,,实验c(NO3-)=3mol/L,则可用6.0molL-1NaNO3和0.2molL-1盐酸等体积混合的溶液代替。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g)![]() 4C(g)+2D(g)在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
4C(g)+2D(g)在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A. v(A)=1.0 mol·L-1·min-1 B. v(B)=1.8 mol·L-1·min-1
C. v(D)=0.2 mol·L-1·s-1 D. v(C)=0.6 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( ) 
A.双酚A的分子式是C15H16O2
B.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
C.反应①中,1mol双酚A最多消耗2 mol Br2
D.反应②的产物中只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如右图所示,图中只有Hg(OH)2为难溶物[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=lgc(Cl-)]。

(1)正常海水(Cl-的浓度大于0.1mol/L)中汞元素的主要存在形态是_______。少量Hg(NO3)2溶于0.001mol/L盐酸后得到无色透明溶液,其中汞元素的主要存在形态是_______。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是_______(用离子方程式表示),为了防止出现浑浊,可采取的措施是_______。
(3)HgCl2是一种弱电解质,结合图像写出其电离方程式为_______。
(4)当溶液PCl保持在4,pH由7改变为3时,可使Hg(OH)2转化为HgCl2,请写出对应的离子方程式_______。
(5)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水,反应的离子方程式为_______。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。己知Ksp(HgS)=1.6×10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素(NA为阿伏加德罗常数的值). 
(1)元素B位于元素周期表的(填“s”、“p”或“d”)区.
(2)由A、X、K三种元素中的某两种形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有
(填分子式).
(3)只含A、E和镍三种元素的晶体具有超导性.该新型超导晶体的一个晶胞如图所示,该晶体的化学式为 .
(4)元素D和K形成的化合物中,每个阳离子周围距离最近且相等的阳离子有个,若该化合物晶体的密度为a g/cm3 , 则晶胞的体积是cm3 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是( )
A.18O只存在于乙酸乙酯中
B.18O存在于水、乙酸、乙醇以及乙酸乙酯中
C.18O存在于乙酸乙酯、乙醇中
D.有的乙醇分子可能不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种食品保鲜剂,可按如下途径合成:

已知;RCHO+CH3CHO![]() RCH(OH)CH2CHO。试回答:
RCH(OH)CH2CHO。试回答:
(1)A的化学名称是________,A→B的反应类型是________ 。
(2)B→C反应的化学方程式为________ 。
(3)C→D所用试剂和反应条件分别是________ 。
(4)E的结构简式是_________。F中官能团的名称是________ 。
(5)连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有____种。其中苯环上只有一个取代基,核磁共振氢谱有5个峰,峰面积比为2:1:2:2:1的同分异构体的结构简式为________ 。
(6)写出用乙醇为原料制备2-丁烯醛的合成路线(其他试剂任选) ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,这四种元素的原子最外层电子数之和是24,下列说法中正确的是( )
X | Y | |
Z | W |
A. 原子半径:![]()
B. 最高价氧化物对应水化物的酸性:![]()
C. 四种元素的单质中,W单质的熔、沸点最高
D. X的气态氢化物可与它的最高价氧化物的水化物发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com