
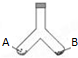
 如图所示是一密闭容器,已知A端盛2.3g金属钠,B端盛有xgHgO,当同时加热容器的两侧支管时,钠着火燃烧,冷却后测得容器中空气成分并未发生变化,求x的值.(Hg的相对原子质量是200.6)
如图所示是一密闭容器,已知A端盛2.3g金属钠,B端盛有xgHgO,当同时加热容器的两侧支管时,钠着火燃烧,冷却后测得容器中空气成分并未发生变化,求x的值.(Hg的相对原子质量是200.6)| 2.3g |
| 23g/mol |


科目:高中化学 来源: 题型:
| A、铜与稀硝酸的反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
| B、氯气与水反应:Cl2+H2O=H++Cl-+HClO |
| C、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、钠和水反应:2Na+H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cu |
| △ |
| KMnO4 |
| H+ |
| A |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇的沸点低于丁醇;正丁烷的沸点高于异丁烷;并且丁醇的沸点高于丁烷 |
| B、用甘氨酸H2NCH(CH3)CHCOOH和H2NCH(CH3)COOH缩合最多可形成4种二肽 |
| C、乙醛、柠檬酸、甲酸、乙酸甲酯、葡萄糖、麦芽糖都能发生银镜反应 |
| D、C4H8属于烯烃类的同分异构体中存在顺反异构的只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | 离子浓度关系 | |
| A | pH<7 | c(CH3COO-)>c(CH3COOH) |
| B | pH>7 | c(CH3COO-)<c(CH3COOH) |
| C | pH=7 | c(CH3COO-)=c(CH3COOH) |
| D | pH<7 | c(CH3COO-)<c(CH3COOH) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液态氯化氢、固体氯化钾均不导电,故HCl和KCl均为非电解质 |
| B、SO2、SO3水溶液都能导电,故二者均为电解质 |
| C、铜和石墨均能导电,所以它们都是电解质 |
| D、蔗糖、乙醇在水溶液中和熔融状态下都不导电,所以它们是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
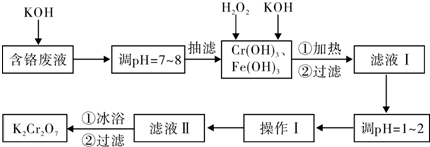
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com