
����Ŀ������β���е���Ҫ��Ⱦ��ΪNOx��CO���к����ʡ�Ŀǰ�����о����˶�����������β����Ⱦ�ķ�����
I.��������ʱ��H2��NO��ԭΪN2��
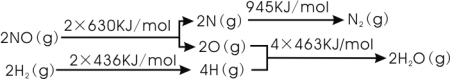
��֪��
��H2��ԭNO���ɵ�����ˮ�������Ȼ�ѧ����ʽ�ǣ�______________________________��
II.�û���̿��ԭ������������йط�ӦΪC(s)+2NO(g)![]() N2(g)+CO2(g)��H=QkJ/mol����2L�����ܱ����м���������C��NO��Ӧ������ʵ���������
N2(g)+CO2(g)��H=QkJ/mol����2L�����ܱ����м���������C��NO��Ӧ������ʵ���������
ʵ���� | �¶�/�� | ��ʼʱNO�����ʵ���/mol | ƽ��ʱN2�����ʵ���/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ________________________________________��
��2����ϱ������ݣ��жϸ÷�Ӧ��Q___0(����>������<��)��������________________________��.
��3���õ���ʽ��ʾ����CO2���γɹ���_________________________________________��
��4���жϸ÷�Ӧ�ﵽƽ���������____________
a.�������������ܶȺ㶨����Ӧ�ﵽƽ��״̬
b.�������ڸ�����Ũ�Ⱥ㶨����Ӧ�ﵽƽ��״̬
c.��������ѹǿ�㶨����Ӧ�ﵽƽ��״̬
d.��2������NO��=���棨N2������Ӧ�ﵽƽ��״̬
���𰸡�2NO(g)+2H2(g)��N2(g)+2H2O(g) ![]() H=-665kJ/mol
H=-665kJ/mol ![]() > ����700����800����ƽ�ⳣ��K1<K2,����
> ����700����800����ƽ�ⳣ��K1<K2,����![]() H>0
H>0 ![]() ab
ab
��������
(1)���������仯ͼ����Ӧ�ϼ�������2��630kJ/mol+2��436kJ/mol=2132kJ/mol���������γɻ�ѧ�����ų�945kJ/mol+4��463kJ/mol=2797kJ/mol�����������Ը÷�Ӧ���ų�2797kJ/mol-2132kJ/mol=665kJ/mol��������
(2)ƽ�ⳣ������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻���
(3)����ʵ��1��ʵ��2����ƽ��״̬��ƽ�ⳣ���ж�����ƽ���ƶ������ƽ���ƶ�ԭ�������жϣ�
(4)������̼����ԭ�Ӻ�̼ԭ��֮��ͨ�����ۼ��γɵĹ��ۻ����C��O֮�京��2�Թ��õ��Ӷԣ�
(5)�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ�������ֵ�Ũ�Ȳ��䣬�ݴ˻ش��жϡ�
(1)���������仯ͼ����Ӧ�ϼ�������2��630kJ/mol+2��436kJ/mol=2132kJ/mol���������γɻ�ѧ�����ų�945kJ/mol+4��463kJ/mol=2797kJ/mol�����������Ը÷�Ӧ���ų�2797kJ/mol-2132kJ/mol=665kJ/mol���������Ȼ�ѧ����ʽΪ2NO(g)+2H2(g)�TN2(g)+2H2O(g)��H=-665 kJmol-1��
(2)ƽ�ⳣ������������ƽ��Ũ���ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻�������ʽΪ��K=![]() ��
��
(3)����ʵ��1��ʵ��2����ƽ��״̬��ƽ�ⳣ���ж�����ƽ���ƶ�����
ʵ��1 C(s)+2NO(g)N2(g)+CO2(g)
��ʼ��(mol/L) 0.2 0 0
�仯��(mol/L) 0.09 0.045 0.045
ƽ����(mol/L) 0.11 0.045 0.045
K1=![]() =0.167��
=0.167��
ʵ��2 C(s)+2NO(g)N2(g)+CO2(g)
��ʼ��(mol/L) 0.12 0 0
�仯��(mol/L) 0.08 0.04 0.04
ƽ����(mol/L) 0.04 0.04 0.04
K2=![]() =1��K1������ƽ�ⳣ������˵����ӦΪ���ȷ�ӦQ��0��
=1��K1������ƽ�ⳣ������˵����ӦΪ���ȷ�ӦQ��0��
(4)Oԭ�Ӻ�Cԭ��ͨ�����õ��Ӷ��γɶ�����̼���������γɹ���Ϊ![]() ��
��
(5)a����Ӧǰ�����������仯��������䣬�������������ܶȺ㶨˵����Ӧ�ﵽƽ��״̬��
b�������ڸ�����Ũ�Ⱥ㶨��ƽ���־��
c����Ӧǰ���������ʵ������䣬������ѹǿ�㶨����˵����Ӧ�ﵽƽ��״̬��
d������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ����Ӧ����֮�ȣ��� ��(NO)=2�� ��(N2)ʱ��Ӧ�ﵽƽ��״̬��ѡ����2�� ��(NO)=�� ��(N2)����˵����Ӧ�ﵽƽ��״̬��
�ʴ�Ϊab��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ķ�Ӧ·��������Ϣ��գ�
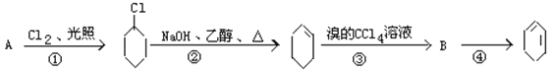
��1��A�Ľṹ��ʽ��_____________��������_______________________��
��2���ٵķ�Ӧ����______________���ڵķ�Ӧ����__________________��
��3����Ӧ�ڵĻ�ѧ����ʽ_______________________________��
��Ӧ�ܵĻ�ѧ����ʽ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ֲ��֦Ҷ��ȡ�ľ����к������мס������ֳɷ֣�
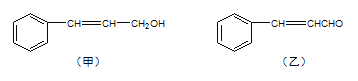
���������գ�
��1�����еĺ��������ŵĵ���ʽΪ____�����к��������ŵ�����Ϊ____��
��2���ɼ�ת��Ϊ���辭���й��̣�
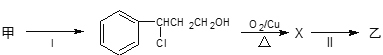
���з�Ӧ��ķ�Ӧ����Ϊ___����Ӧ��Ļ�ѧ����ʽΪ___����Ӧ����Ϊ___����Ʒ�Ӧ���Ŀ����___��
��3�����������е�̼̼˫������ѡ�õ��Լ���____����ѡ����ѡ���ԭ��____��
a����ˮ b�����Ը��������Һ c�����CCl4��Һ d��������Һ
��4���Ҿ����⻯�������õ�����![]() �������ж���ͬ���칹�壬д�����ϱ�������һ��ȡ���������������ͬ���칹��____��д�������ܷ���������Ӧ��һ�����ڼ��������µ�ˮ�ⷴӦ�Ļ�ѧ����ʽ____��
�������ж���ͬ���칹�壬д�����ϱ�������һ��ȡ���������������ͬ���칹��____��д�������ܷ���������Ӧ��һ�����ڼ��������µ�ˮ�ⷴӦ�Ļ�ѧ����ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����P��S��Cl��Ni��Ԫ����ɵ����Ͳ������Ź㷺����;���ش��������⡣
��1����̬Clԭ�Ӻ�������Ų�ʽΪ____��P��S��Cl�ĵ�һ�������ɴ�С˳��Ϊ____��
��2��SCl2�����е�����ԭ���ӻ����������____���÷��ӹ���Ϊ_____��
��3��Ni��CO���γ������Ni(CO)4���÷�������λ������Ϊ____������������ʾ��������������ʾ��λ����д��Ni(CO)4���ӵĽṹʽ____��
��4����֪MgO��NiO�ľ���ṹ(��ͼ)��ͬ������Mg2+��Ni2+�����Ӱ뾶�ֱ�Ϊ66 pm��69pm�����۵㣺MgO_____NiO(������������������������)��������____��
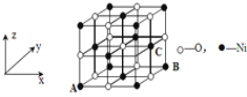
��5����NiO�����������������AΪ(0��0��0)��BΪ(1��1��0)����C�����������Ϊ____��
��6�����ʯ��������___��̼ԭ�ӡ���̼ԭ�Ӱ뾶Ϊr�����ʯ�����ı߳�Ϊa������Ӳ��Ӵ�ģ�ͣ���r= ______a����ʽ��ʾ̼ԭ���ھ����еĿռ�ռ����____������r��a��ʾ��Ҫ�����������
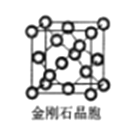
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ������һ�ֳ����Ľ�����ʹҩ���ṹ��ʽ��ͼ��ʾ�������й�������ȷ����

A.����ˮ����ķ���ʽΪC9H10O4
B.����ˮ����ĺ���������������
C.����NaHCO3��Һ��Ӧ�Ĺ�������һ��
D.����(C4H9)ȡ������ˮ���ᱽ���ϵ���ԭ�ӣ�������γ�4��ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���X�Ľṹ��ʽ��ͼ��ʾ�������й���������ȷ���ǣ� ��
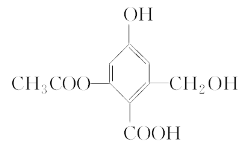
A. 1 mol X������3 mol H2�����ӳɷ�Ӧ
B. X��һ������������FeCl3��Һ������ɫ��Ӧ
C. X��һ���������ܷ�����ȥ��Ӧ��������Ӧ
D. 1 mol X�ֱ���������Na��NaOH��Һ��NaHCO3��Һ��Ӧ������Na��NaOH��NaHCO3�����ʵ����ֱ�Ϊ3 mol��4 mol��1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
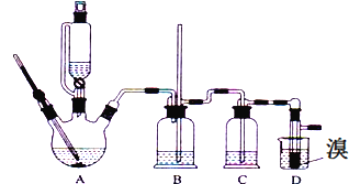
����Ŀ��ʵ����������������������Ҵ���Ũ�����Ʊ�1��2�����������װ������ͼ��ʾ�����п��ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѡ��й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | -l30 | 9 | -1l6 |
�ش��������⣺
��1��������������������Ҵ���Ũ�����Ʊ�1��2���������������������У��ڶ�����Ӧ�Ļ�ѧ����ʽΪ_______________
��2���ڴ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����_______������ȷѡ��ǰ����ĸ����
a��������Ӧ b���ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��3����װ��C��Ӧ����_______����Ŀ�������շ�Ӧ�п������ɵ��������壨����ȷѡ��ǰ����ĸ����
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��4����1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��________�㣨��������������������
��5����������������δ��Ӧ��Br2�������__________ϴ�ӳ�ȥ����ѡ��ǰ��ĸ����
a��ˮ b������������Һ c���⻯����Һ d���Ҵ�
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ������ϩ���巴Ӧʱ���ȣ���ȴ�ɱ�����Ĵ����ӷ������ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����51.2g Cu��ȫ��������Ũ�����У��ռ��������������NO��N2O4��NO2���Ļ���ﹲ0.8mol����Щ����ǡ���ܱ�500 mL NaOH��Һ��ȫ���գ�����NaNO2��NaNO3��������Һ������NaNO3�����ʵ���Ϊ0.2mol����NaOH��Ũ��Ϊ �� ��
A.1.8mol/LB.2mol/LC.2.4 mol/LD.3.6 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������Ʒ�к�������������������ijͬѧҪ�ⶨ������Ԫ�ص��������������������ʵ�鷽����

(1)��������������Һʱ�����õ��IJ����������ձ�����Ͳ������������ͷ�ι����⣬��������__________(����������)��
(2)��Ӧ���м�������H2O2��Һ����Ӧ�����ӷ���ʽ��_______________________________��
(3)���������![]() �Ƿ�ϴ�Ӹɾ��IJ�����_______________________________________��
�Ƿ�ϴ�Ӹɾ��IJ�����_______________________________________��
(4)���������ȣ���ȴ�����£�����ƽ������������Ⱥ�����������Ϊb1g���ٴμ��Ȳ���ȴ�����³�������Ϊb2g����b1��b2��0.3����Ӧ���еIJ�����_____________________��
(5)����������Ϊ42.6 g��������������Ⱥ�Ĺ����������Ϊ45.8 g������Ʒ����Ԫ�ص���������Ϊ________________��
(6)��ͬѧ��Ϊ����������ʵ�鲽��̫����������Ϊ��ֻҪ����Ʒ����ˮ��ֽ��裬���ȡ����ɡ����ճ������ɲ����Ʒ����Ԫ�ص���������������Ϊ������������Ƿ���У�__________(����С������С�)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com