
ЁОЬтФПЁПзюНќПЦбЇМвЬсГіЁАТЬЩЋздгЩЁБЙЙЯыЃКАбКЌгаДѓСПCO2ЕФПеЦјДЕШыЬМЫсМиШмвКжаЃЌдйАбCO2ДгШмвКжаЬсШЁГіРДЃЌВЂЪЙжЎгыЧтЦјЗДгІЩњГЩПЩдйЩњФмдДМзДМЁЃЦфЙЄвеСїГЬШчЭМЫљЪОЃК
ЃЈ1ЃЉаДГіЗжНтГижаЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______________ЃЛ
ЃЈ2ЃЉдкКЯГЩЫўжаЃЌШєга4.4kg CO2гызуСПH2ЧЁКУЭъШЋЗДгІЃЌЩњГЩЦјЬЌЕФЫЎКЭМзДМЃЌПЩЗХГі4947kJЕФШШСПЃЌЪдаДГіИУЗДгІЕФШШЛЏбЇЗНГЬЪН_______________ЃЛ
ЃЈ3ЃЉвбжЊКЯГЩЫўжаЕФЗДгІЪЧПЩФцЕФЃЌИљОнЦНКтвЦЖЏдРэЃЌЕЭЮТгаРћгкдСЯЦјЕФзЊЛЏЃЌЖјЪЕМЪЩњВњжаВЩгУ300ЁцЕФЮТЖШЃЌЦфдвђПЩФмЪЧ_______________ЃЛ
ЃЈ4ЃЉЁАТЬЩЋздгЩЁБЙЙЯыСїГЬжаГЃАќРЈЮяжЪЕФЁАбЛЗРћгУЁБЃЌЩЯЪіСїГЬжаФмЬхЯжЁАбЛЗРћгУЁБЕФЮяжЪГ§ЬМЫсМиШмвКЭтЃЌЛЙАќРЈ________(ЛЏбЇЪН)ЁЃ
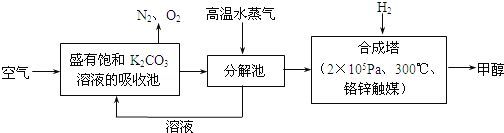
ЃЈ5ЃЉ300ЁцЪБЃЌНЋCOКЭH2АД1:3ЕФЬхЛ§БШГфШыУмБеШнЦїжаЃЌCO2ЕФЦНКтзЊЛЏТЪ(ІС)гыЬхЯЕзмбЙЧП(p)ЕФЙиЯЕШчЭМЫљЪОЁЃИљОнЭМЪОЛиД№ЯТСаЮЪЬтЃК
ЂйШєЦфЫћЬѕМўВЛБфЃЌНЋAЕуЕФЬхЛ§бЙЫѕжСдРДЕФвЛАыЃЌвЛЖЮЪБМфКѓЗДгІдйДяЦНКтЪЧЃЌгыдЦНКтБШНЯЯТСаЫЕЗЈе§ШЗЕФЪЧ________ЁЃ
AЃЎCO2ЕФХЈЖШМѕаЁ |
BЃЎе§ЗДгІЫйТЪдіДѓЃЌФцЗДгІЫйТЪМѕаЁ |
CЃЎCO2КЭH2ЕФЬхЛ§БШЮЊ1:3 |
DЃЎCH3OHЕФЬхЛ§ЗжЪ§діДѓ |
ЂкНЋ1.0molCO2КЭ3.0molH2жУгкЬхЛ§ВЛБфЕФУмБеШнЦїжаЃЌ2minЪБЗДгІДяЕНЦНКтЃЌДЫЪБЬхЯЕзмбЙЧПЮЊ0.10MPaЃЌгУH2БэЪОЕФЗДгІЫйТЪЮЊ1.2mol/(LЁЄmin)ЃЌдђУмБеШнЦїЕФЬхЛ§ЪЧ____LЁЃ
ЃЈ6ЃЉМзДМПЩжЦзїШМСЯЕчГиЁЃвдЧтбѕЛЏМиШмвКЮЊЕчНтжЪЕФИКМЋЗДгІЪНЪЧ__________ЁЃЕБзЊвЦЕФЕчзгЕФЮяжЪЕФСПЮЊ_______molЪБЃЌВЮМгЗДгІЕФбѕЦјЕФЬхЛ§ЪЧ6.72L(БъзМзДПіЯТ)ЁЃ
ЁОД№АИЁП2KHCO3![]() K2CO3+H2O+CO2Ёќ CO2(g)+3H2(g)ЈTCH3OH(g)+H2O(g)ЁїH=-49.47kJ/mol МгПьЗДгІЫйТЪЃЌЪЙДпЛЏМСЛюадНЯИп ИпЮТЫЎеєЦј CD 1 CH3OH+8OH--6e-=CO32-+6H2O 1.2
K2CO3+H2O+CO2Ёќ CO2(g)+3H2(g)ЈTCH3OH(g)+H2O(g)ЁїH=-49.47kJ/mol МгПьЗДгІЫйТЪЃЌЪЙДпЛЏМСЛюадНЯИп ИпЮТЫЎеєЦј CD 1 CH3OH+8OH--6e-=CO32-+6H2O 1.2
ЁОНтЮіЁП
ЃЈ1ЃЉЬМЫсЧтМиЪмШШПЩЗжНтГЩЬМЫсМиЁЂЖўбѕЛЏЬМКЭЫЎЃЌЗНГЬЪНЮЊЃК2KHCO3![]() K2CO3+H2O+CO2ЁќЃЛ
K2CO3+H2O+CO2ЁќЃЛ
ЃЈ2ЃЉИљОн4.4 kg CO2гызуСПH2ЧЁКУЭъШЋЗДгІЃЌПЩЗХГі4 947 kJЕФШШСПЃЌдђ1 mol CO2гыЧтЦјКЯГЩМзДМЗХГіШШСП49.47 kJЕФШШСПЃЌЫљвдШШЛЏбЇЗНГЬЪНЮЊCO2(g)+3H2(g)ЈTCH3OH(g)+H2O(g)ЁїH=-49.47kJ/molЃЌЙЪД№АИЮЊCO2(g)+3H2(g)ЈTCH3OH(g)+H2O(g)ЁїH=-49.47kJ/molЃЛ
ЃЈ3ЃЉКЯГЩЫўФкЗЂЩњЕФЗДгІЮЊCO2(g)+3H2(g)ЈTCH3OH(g)+H2O(g)ЁїH=-49.47kJ/molЃЌЩ§ЮТЦНКтФцЯђвЦЖЏЃЌЕЋЗДгІЫйТЪНЯИпЃЌЪЙДпЛЏМСЕФЛюадНЯИпЃЌЙЪЭЈГЃбЁдёНЯИпЮТЖШЯТНјааЃЛ
ЃЈ4ЃЉЩЯЪіЗДгІСїГЬжаЗжНтФкKHCO3ЗжНтЩњГЩЕФЬМЫсМиКЭЫЎЦћМАКЯГЩМзДМЪБЕУЕНЕФЫЎЦћПЩвдбЛЗРћгУЃЛ
ЃЈ5ЃЉЂйAЃЎЬхЛ§МѕЩйвЛАыЃЌCO2ЕФХЈЖШЫВМфдіДѓЮЊдРДЕФЦНКтЃЌЦНКтЯђе§ЗДгІЯђвЦЖЏЃЌИљОнРеЯФЬиСадРэЃЌЦНКтКѓCO2ЕФХЈЖШШдБШдРДДѓЃЌЙЪAДэЮѓЃЛBЃЎЬхЛ§МѕЩйЃЌбЙЧПдіДѓЃЌе§ЗДгІЫйТЪКЭФцЗДгІЫйТЪОљдіДѓЃЌЙЪBДэЮѓЃЛCЃЎCO2КЭH2ЕФЦ№ЪМСПЮЊ1:3ЃЌБфЛЏСПвВЪЧ1:3ЃЌвђДЫЦНКтКѓЬхЛ§БШШдЮЊ1:3ЃЌЙЪCе§ШЗЃЛDЃЎЬхЛ§МѕаЁЃЌЦНКтЯђе§ЗНЯђвЦЖЏЃЌCH3OHЕФЬхЛ§ЗжЪ§діДѓЃЌЙЪDе§ШЗЃЛД№АИЮЊCDЁЃЂкМйЩшШнЦїЬхЛ§ЮЊVLЃЌH2БэЪОЕФЗДгІЫйТЪЮЊ1.2mol/(LЁЄmin)ЃЌИљОнЗДгІЫйТЪЕФМЦЫуЙЋЪНПЩжЊЃЌH2ЕФБфЛЏЮяжЪЕФСПЮЊ1.2mol/(LЁЄmin)ЁС2minЁСVL=2.4VmolЃЌНсКЯЗДгІCO2(g)+3H2(g)ЈTCH3OH(g)+H2OЃЌдђCO2БфЛЏЕФЮяжЪЕФСПЪЧ0.8VmolЃЌДЫЪБCO2зЊЛЏТЪЮЊ0.8Vmol/1mol=0.8ЃЌЕУV=1LЃЛ
ЃЈ6ЃЉМзДМШМСЯМюадЕчГижаЃЌМзДМдкИКМЋЩЯЗЂЩњбѕЛЏЗДгІЃЌМзДМЪЇЕчзгКЭЧтбѕИљРызгЗДгІЩњГЩЬМЫсИљРызгКЭЫЎЃЌЕчМЋЗДгІЪНЮЊCH3OH+8OH--6e-=CO32-+6H2OЃЛВЮМгЗДгІЕФбѕЦјЕФЬхЛ§ЪЧ6.72L(БъзМзДПіЯТ)ЮяжЪЕФСПЮЊ0.3molЃЌO2+2H2O+4e-=4OH-ЃЌзЊвЦЕчзгЮяжЪЕФСПЮЊ1.2molЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљЦЄЫиJ(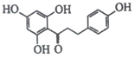 )ЪЧЙњЭтаТНќбаОППЊЗЂГіРДЕФвЛжжаТаЭЬьШЛУРАзМС,жївЊЗжВМгкЦЛЙћЁЂРцЕШЖржЫЎЙћЕФЙћЦЄМАИљЦЄ.ЦфжавЛжжКЯГЩJЕФТЗЯпШчЯТЃК
)ЪЧЙњЭтаТНќбаОППЊЗЂГіРДЕФвЛжжаТаЭЬьШЛУРАзМС,жївЊЗжВМгкЦЛЙћЁЂРцЕШЖржЫЎЙћЕФЙћЦЄМАИљЦЄ.ЦфжавЛжжКЯГЩJЕФТЗЯпШчЯТЃК
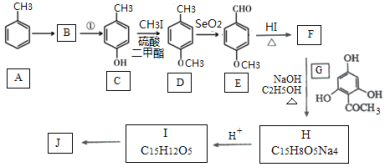
вбжЊЃК
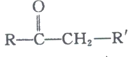 +RЁЏЁЏCHO
+RЁЏЁЏCHO +H2O
+H2O
ЛиД№ЯТСаЮЪЬтЃК
(1)CЕФЛЏбЇУћГЦЪЧ___________.EжаЕФЙйФмЭХЕФУћГЦЮЊ_______________.
(2)BЮЊфхДњЬў,ЧыаДГіAЁњBЕФЗДгІЬѕМў___________.
(3)аДГігЩCЩњГЩDКЭгЩDЩњГЩEЕФЗДгІРраЭ___________ЁЂ___________.
(4)FЁњHЕФЛЏбЇЗНГЬЪНЮЊ______________________.
(5)MЪЧEЕФЭЌЗжвьЙЙЬх,ЭЌЪБЗћКЯЯТСаЬѕМўЕФMЕФНсЙЙга___________жж(ВЛПМТЧСЂЬхвьЙЙ)
ЂйФмгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІ ЂкФмЗЂЩњвјОЕЗДгІ
(6)ЩшМЦвдБћЯЉКЭ1,3ЃБћЖўШЉЮЊЦ№ЪМдСЯжЦБИ![]() ЕФКЯГЩТЗЯп_______(ЮоЛњЪдМСШЮбЁ).
ЕФКЯГЩТЗЯп_______(ЮоЛњЪдМСШЮбЁ).
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌдкШ§ИіЬхЛ§ОљЮЊ2.0 LЕФКуШнУмБеШнЦїжаЗЂЩњЗДгІЃКPCl5(g)![]() PCl3(g)+Cl2(g)ЁЃ
PCl3(g)+Cl2(g)ЁЃ
БрКХ | ЮТЖШ /Ёц | Ц№ЪМЮяжЪ ЕФСП/mol | ЦНКтЮяжЪ ЕФСП/mol | ДяЕНЦНКт ЫљашЪБМф/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ђё | 320 | 0.40 | 0.10 | 0.10 | t |
Ђђ | 320 | 0.80 | t1 | ||
Ђѓ | 410 | 0.40 | 0.15 | 0.15 | t2 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.ЦНКтГЃЪ§KЃКШнЦїЂђ>ШнЦїЂѓ
B.ЗДгІЕНДяЦНКтЪБЃЌPCl5ЕФзЊЛЏТЪЃКШнЦїЂђ>ШнЦїЂё
C.ЗДгІЕНДяЦНКтЪБЃЌШнЦїЂёжаЕФЦНОљЫйТЪЮЊv(PCl5)=![]() molЁЄL-1ЁЄs-1
molЁЄL-1ЁЄs-1
D.Ц№ЪМЪБЯђШнЦїЂѓжаГфШыPCl5 0.30 molЁЂPCl3 0.45 molКЭCl2 0.10 molЃЌдђЗДгІНЋЯђФцЗДгІЗНЯђНјаа
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђвЛЖЈХЈЖШЕФBa(OH)2ШмвКжаЕЮШыФГХЈЖШЕФNH4HSO4ШмвКЃЌЦфЕМЕчФмСІЫцЕЮШыШмвКЬхЛ§ЕФБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
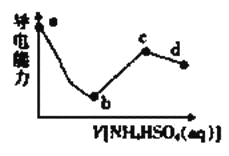
A.bЕуШмвКжажЛДцдкH2OЕФЕчРыЦНКтКЭBaSO4ЕФГСЕэШмНтЦНКт
B.cЕуЙівКжаЃКc(H+)+c(NH4+)=c(NH3H2O)+c(OH-)
C.abЖЮЗДгІЕФРызгЗНГЬЪНЮЊ![]()
D.bcЖЮжЎМфДцдкФГЕуЃЌЦфШмвКжаЃКc(NH4+)=2c(SO42-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. дкЫсадЬѕМўЯТЃЌCH3CO18OC2H5ЕФЫЎНтВњЮяЪЧCH3COOH КЭ C2H518OH
B. ввШЉКЭБћЯЉШЉВЛЪЧЭЌЯЕЮяЃЌЫќУЧгыH2 ГфЗжЗДгІКѓЕФВњЮяЪЧЭЌЯЕЮя
C. МзБНФмЪЙЫсадИпУЬЫсМиШмвКЭЪЩЋЃЌЬхЯжСЫВрСДЖдБНЛЗЕФгАЯь
D. ШщЫсБЁКЩДМѕЅ(![]() )ФмЗЂЩњЫЎНтЗДгІЁЂбѕЛЏЗДгІЁЂЯћШЅЗДгІЁЂШЁДњЗДгІ
)ФмЗЂЩњЫЎНтЗДгІЁЂбѕЛЏЗДгІЁЂЯћШЅЗДгІЁЂШЁДњЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
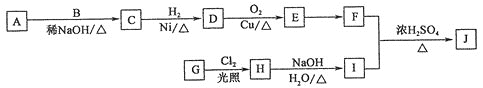
ЁОЬтФПЁПРБНЗЫиѕЅОпгаДйНјЬхФкжЌЗОбѕЛЏЕФЙІФмЃЌПЩгУгкжЮСЦЗЪХжжЂЃЌКЯГЩФГРБНЗЫиѕЅJ(![]() )ЕФСїГЬШчЭМЫљЪОЁЃAЁЂBЁЂEжаЕФКЌбѕЙйФмЭХжжРрЯрЭЌЃЌAКЭBКЫДХЙВеёЧтЦзОљга2ИіЗхЃЌAЯрЖдЗжзгжЪСПБШBЕФДѓЁЃ
)ЕФСїГЬШчЭМЫљЪОЁЃAЁЂBЁЂEжаЕФКЌбѕЙйФмЭХжжРрЯрЭЌЃЌAКЭBКЫДХЙВеёЧтЦзОљга2ИіЗхЃЌAЯрЖдЗжзгжЪСПБШBЕФДѓЁЃ
вбжЊЃК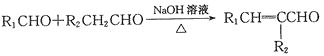
ЂХJжаЙйФмЭХГ§єЧЛљЭтЛЙга________ЃЌGЁњHЕФЗДгІРраЭЮЊ________ЁЃ
ЂЦDЕФНсЙЙМђЪНЮЊ______________ЃЌAЕФУћГЦЪЧ________________ЁЃ
ЂЧаДГіHЁњIЕФЛЏбЇЗДгІЗНГЬЪНЃК_______________________________________________ЁЃ
ЂШEгаЖржжЭЌЗжвьЙЙЬхЃЌЦфжаТњзуЯТСаЬѕМўЕФга________жжЃЌаДГіКЫДХЙВеёЧтЦзга3ИіЗхЕФЮяжЪЕФНсЙЙМђЪНЃК__________________ЁЃ
ЂйЗжзгжаКЌгаСНИіМзЛљЂкКЌгаЬМбѕЫЋМќ
ЂЩвдввШЉЮЊЛљБОдСЯЃЌОШ§ВНЗДгІжЦБИ![]() ТШЖЁЫсЃЌЗТееЩЯЪіБэДяЗНЪНЃЌаДГіЯргІЕФСїГЬЭМЃК____________________________________ЁЃ
ТШЖЁЫсЃЌЗТееЩЯЪіБэДяЗНЪНЃЌаДГіЯргІЕФСїГЬЭМЃК____________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввѕЃЫЎбюЫсМДАЂЫОЦЅСжЪЧзюГЃгУЕФНтШШеђЭДвЉЃЌЦфНсЙЙШчЭМЫљЪОЁЃЙигкЫќЕФУшЪіжаВЛе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
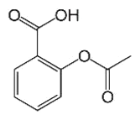
A.ЗжзгЪНЮЊC9H8O4
B.1mol ввѕЃЫЎбюЫсзюЖрПЩвдгы2molNaOHЗДгІ
C.1molввѕЃЫЎбюЫсзюЖрПЩвдгы3molH2ЗДгІ
D.ЦфдкЫсадЬѕМўЯТЫЎНтВњЮягіТШЛЏЬњШмвКПЩвдГЪЯжзЯЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧЃЈ ЃЉ
ШѕЫс | CH3COOH | HClO | H2CO3 |
ЕчРыЦНКтГЃЪ§(25Ёц) | K1=1.760ЁС10-5 | K1=2.95ЁС10-8 | K1=4.30ЁС10-7 K2=5.60ЁС10-11 |
A.pHЯрЭЌЕФЂйCH3COONa ЂкNaHCO3ЂлNaClOШ§жжШмвКжаc(Na+):Ђл<Ђк<Ђй
B.вЛЖЈХЈЖШЕФNaHSШмвКжаЃКc(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.pH=aЕФАБЫЎЃЌЯЁЪЭжСдЬхЛ§ЕФ10БЖКѓЃЌЦфpH=bЃЌдђb>a-1
D.ЩйСПЕФ![]() ЭЈШыNaClOШмвКжаЗЂЩњЗДгІЃК
ЭЈШыNaClOШмвКжаЗЂЩњЗДгІЃК![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЭЌбЇЮЊСЫЬНОПаПгыбЮЫсЗДгІЙ§ГЬжаЕФЫйТЪБфЛЏЃЌЫћдк100mLЯЁбЮЫсжаМгШызуСПЕФаПЗлЃЌгУХХЫЎМЏЦјЗЈЪеМЏЗДгІЗХГіЕФЧтЦјЃЈЦјЬхЬхЛ§вбелЫуЮЊБъзМзДПіЯТЕФЬхЛ§ЃЉЃЌЪЕбщМЧТМШчЯТЃЈРлМЦжЕЃЉЃК
ЪБМф/min | 1 | 2 | 3 | 4 | 5 |
ЧтЦјЬхЛ§/mL | 50 | 120 | 232 | 290 | 310 |
ЃЈ1ЃЉЗДгІЫйТЪзюДѓЕФЪБМфЖЮЪЧ__ЃЈЬюЁА0ЁЋ1minЁБЁА1ЁЋ2minЁБЁА2ЁЋ3minЁБЛђЁА4ЁЋ5minЁБЃЉЃЌдвђЪЧ__ЁЃ
ЃЈ2ЃЉЗДгІЫйТЪзюаЁЕФЪБМфЖЮЪЧ__ЃЈЬюЁА0ЁЋ1minЁБЁА1ЁЋ2minЁБЁА2ЁЋ3minЁБЛђЁА4ЁЋ5minЁБЃЉЃЌдвђЪЧ__ЁЃ
ЃЈ3ЃЉ2ЁЋ3minЪБМфЖЮФкЃЌвдбЮЫсЕФХЈЖШБфЛЏБэЪОИУЗДгІЕФЫйТЪЮЊ__ЁЃ
ЃЈ4ЃЉШчЙћЗДгІЬЋОчСвЃЌЮЊСЫМѕЛКЗДгІЫйТЪЖјгжВЛМѕЩйВњЩњЧтЦјЕФСПЃЌИУЭЌбЇдкбЮЫсжаЗжБ№МгШыЕШЬхЛ§ЕФЯТСавКЬхЃЌФуШЯЮЊПЩааЕФЪЧ__ЃЈЬюађКХЃЉЁЃ
A.еєСѓЫЎ B.NaClШмвК C.Na2CO3ШмвК D.CuSO4ШмвК
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com