
【题目】下列说法中不正确的是( )
弱酸 | CH3COOH | HClO | H2CO3 |
电离平衡常数(25℃) | K1=1.760×10-5 | K1=2.95×10-8 | K1=4.30×10-7 K2=5.60×10-11 |
A.pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中c(Na+):③<②<①
B.一定浓度的NaHS溶液中:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.pH=a的氨水,稀释至原体积的10倍后,其pH=b,则b>a-1
D.少量的![]() 通入NaClO溶液中发生反应:
通入NaClO溶液中发生反应:![]()
【答案】D
【解析】
A.根据表格可知醋酸酸性最强,次氯酸酸性最弱,越弱盐类水解规律越弱越水解可得,pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中c(Na+):③<②<①,A项正确,不符合题意;
B.根据电荷守恒可知应有NaHS溶液中:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),B项正确,不符合题意;
C.氨水是弱电解质,稀释会向电离方向移动,所以pH=a的氨水,稀释至原体积的10倍后,其pH=b,则b>a-1,C项正确,不符合题意;
D.根据表格可知,次氯酸的电离平衡常数大于碳酸的二级电离平衡常数,所以少量的CO2通入NaClO溶液中发生反应应为:![]() ,D项错误,符合题意;
,D项错误,符合题意;
答案选D。


科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家提出“绿色自由”构想:把含有大量CO2的空气吹入碳酸钾溶液中,再把CO2从溶液中提取出来,并使之与氢气反应生成可再生能源甲醇。其工艺流程如图所示:
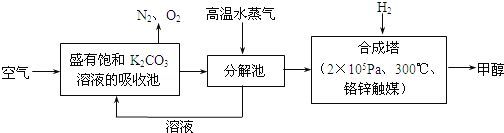
(1)写出分解池中反应的化学方程式为_______________;
(2)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出4947kJ的热量,试写出该反应的热化学方程式_______________;
(3)已知合成塔中的反应是可逆的,根据平衡移动原理,低温有利于原料气的转化,而实际生产中采用300℃的温度,其原因可能是_______________;
(4)“绿色自由”构想流程中常包括物质的“循环利用”,上述流程中能体现“循环利用”的物质除碳酸钾溶液外,还包括________(化学式)。
(5)300℃时,将CO和H2按1:3的体积比充入密闭容器中,CO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
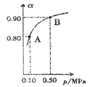
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再达平衡是,与原平衡比较下列说法正确的是________。
A.CO2的浓度减小 |
B.正反应速率增大,逆反应速率减小 |
C.CO2和H2的体积比为1:3 |
D.CH3OH的体积分数增大 |
②将1.0molCO2和3.0molH2置于体积不变的密闭容器中,2min时反应达到平衡,此时体系总压强为0.10MPa,用H2表示的反应速率为1.2mol/(L·min),则密闭容器的体积是____L。
(6)甲醇可制作燃料电池。以氢氧化钾溶液为电解质的负极反应式是__________。当转移的电子的物质的量为_______mol时,参加反应的氧气的体积是6.72L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol I2(g)和2 mol H2置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
(1)达到平衡时,I2(g)的物质的量浓度为______________mol·L-1。
(2)若改变反应条件,在甲条件下w(HI)的变化如图曲线(Ⅱ)所示,在乙条件下w(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是______________,乙条件可能是______________。(填入下列条件的序号)
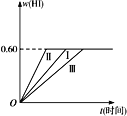
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g),b mol H2(g)和c molHI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
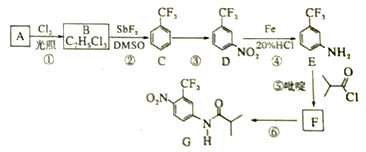
回答下列问题:
(1)A的结构简式为_______________。C的化学名称是________________________。
(2)③的反应试剂和反应条件分别是______________________,该反应的类型是___________。
(3)⑤的反应方程式为_____________________________________________。
吡啶是一种有机碱,其作用是______________________________。
(4)G的分子式为______________________________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则Ⅱ可能的结构有_________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
)制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要有机物,其合成路线如下:
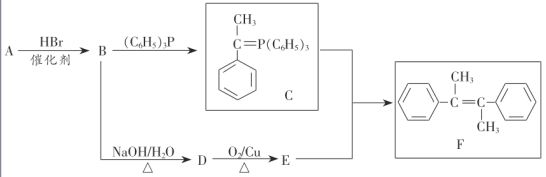
已知:①烃A的相对分子质量为104;
②E的核磁共振氢谱有4组吸收峰;
③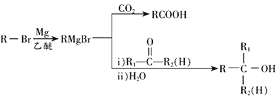
请回答以下问题:
⑴A的化学名称为________,E中官能团名称是________
⑵B→D的反应类型为________,F中共平面的碳原子最多有________个.
⑶D→E的化学方程式为________
⑷上述流程中可能得到一种与E互为同分异构体的副产物,该物质的结构简式为________
⑸D的一种同分异构体X,能与FeCl3溶液发生显色反应,则X共有________种.![]() 不含立体异构
不含立体异构![]()
⑹参照题干有关信息,设计一条由溴苯和乙醇为原料制备A的合成路线:________(其他无机试剂和溶剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下:
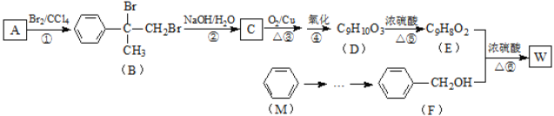
已知:![]() +CH3Cl
+CH3Cl![]()
![]() +HCl
+HCl
请回答下列问题:
(1)F的名称是_______,⑥的反应类型是________;
(2)W的结构简式为_____________;
(3)反应②的化学方程式是____________;
(4)反应③的化学方程式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com