
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.25C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA
B.标况下,22.4L Cl2与足量Fe和Cu混合物点燃,反应后,转移的电子数为2 NA个
C.50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
D.标准状况下,11.2L SO3含有分子数为0.5NA
科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
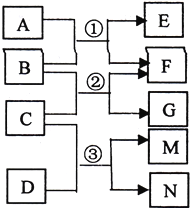
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某儿童微量元素体检报告单的部分数据,根据数据,回答下列问题:
北京市医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 |
| 66~120 |
2 | 铁(Fe) | 6.95↓ |
| 7.52~11.82 |
3 | 钙(Ca) | 1.68 |
| 1.55~2.10 |
(1)该儿童体内_________元素含量偏低。
(2)报告单中“μmol·L-1”是__________(填“质量”“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的________性。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,将硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是_______________________。
(5)取补血剂片用研钵研细,加入过量稀硫酸,取澄清液,然后滴加KSCN溶液,若溶液变为红色,则溶液中含有________(填离子符号),说明补血剂是否变质____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜在生活中有广泛的应用。CuCl2和CuCl是两种常见的盐,广泛应用于工业生产。
I. CuCl2固体遇水易水解。实验室用如图所示的实验仪器及药品来制备纯净、干燥的氯气,并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。

(1)写出装置A中,发生反应的化学反应方程式:____,装置C的作用是____
(2)完成上述实验,按气流方向连接各仪器接口的顺序是a→___。(每种仪器限使用一次)
(3)上述D装置的作用是____
Ⅱ. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。CuCl晶体呈白色,露置于潮湿空气中易被氧化。
方法一:向上述制得的氯化铜溶液中通入SO2,加热一段时间即可制得CuCl,写出该反应的离子方程式:___。
方法二:铜粉还原CuSO4溶液
![]()
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)①中,“加热”温度不宜过高和过低,目的是___,当观察到__现象,即表明反应已经完全。
(2)②中,加入大量水的作用是___。(从平衡角度解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。空气吹出法工艺,是目前“海水提漠”的最主要方法之一。其工艺流程如图所示,试回答下列问题:
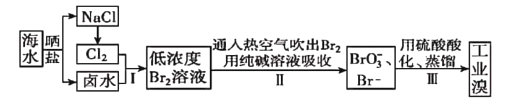
(1)以上步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是_____。
(2)步骤②通入热空气或水蒸气吹出![]() ,利用了溴的___。
,利用了溴的___。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
![]() ____
____
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:____。
(5)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(1)ClO2的制备:
已知:SO2+NaClO3+H2SO4=2ClO2↑+2NaHSO4
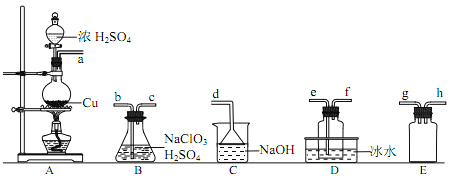
①装置A中反应的化学方程式为________________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为A→_______、_______、_______→C(按气流方向)。
③装置D的作用是_______________。
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。
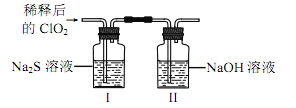
操作步骤 | 实验现象 | 结论 |
取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无___生成 |
另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②____________ | 有SO42生成 |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙内_________ | 有白色沉淀生成 | 有Cl生成 |
④ClO2与Na2S反应的离子方程式为___________。用于处理含硫废水时,ClO2相对于Cl2的优点是______________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中A为银白色固体,B为淡黄色固体,它们有如图所示的转化关系:
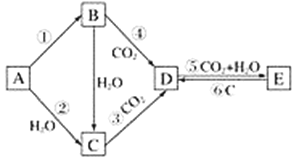
(1)推断各符号所代表的物质的化学式:
A________________,B________________,C________________,D________________,E________________。
(2)分别写出反应②⑤的化学方程式:
②________________________________________________________________________;
⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:

将Na2O2逐渐加入上述混合解液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如下图所示。

回答下列问题:
(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加):_________
(2)图中a=_________,6=_________,c=_________
(3)简述溶液中还可能大量含有的离子的鉴定方法:_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com