
����Ŀ��ij����һ����Ҫ�Ļ���ԭ�ϣ���ӡȾ���Ƹľ�ĺ�ũҵ����������Ҫ��;������Һ���ܺ���NH![]() ��Al3����SO
��Al3����SO![]() ��Fe2����Cl�������������ӣ�ijͬѧ��Ʋ����������ʵ�飺
��Fe2����Cl�������������ӣ�ijͬѧ��Ʋ����������ʵ�飺
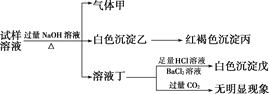
�������ϵ�ʵ�����������ͬѧ�ó��Ľ��۲���ȷ����(����)
A. ������Һ�п϶���NH![]() ��SO
��SO![]() ��Fe2��
��Fe2��
B. ������Һ��һ��û��Al3��
C. ��������ڱ�״�������Ϊ0.448 L���������ͳ�����ֱ�Ϊ1.07 g��4.66 g������ж�������Һ�л���Cl��
D. �����ڹ�ҵ�Ͽ���������ˮ��
���𰸡�C
��������
�������NaOH��Һ�����ȣ��õ�����ף�������Ϊ������ԭ��Һ��һ������NH4����������ɫ������Ϊ���������������ɫ������Ϊ����������ԭ��Һ��һ������Fe2������Һͨ�������̼��������ԭ��Һ��һ��������Al3��������HCl��BaCl2��Һ��������ɫ����ΪBaSO4��ԭ��Һ�к���SO42����
A�������ӦΪNH3������������Һ�к���NH![]() �����ݳ����Һͳ�������֪��������Һ�к���Fe2�������ݰ�ɫ�����켰ͨ�����CO2�����������������ж�������Һ�к���SO
�����ݳ����Һͳ�������֪��������Һ�к���Fe2�������ݰ�ɫ�����켰ͨ�����CO2�����������������ж�������Һ�к���SO![]() ����Al3���������������������п϶���NH4����SO42����Fe2������A��ȷ��
����Al3���������������������п϶���NH4����SO42����Fe2������A��ȷ��
B��������������������Һ��һ��û��Al3������B��ȷ��
C����������ڱ�״�������Ϊ0.448L����NH4��Ϊ0.02mol��������1.07g����Fe2��Ϊ
1.07g/107g��mol��1=0.01mol��������4.66g���Ƴ�SO42��Ϊ4.66g/233g��mol��1=0.02mol�����ݵ���غ㣬�жϳ���Һ��û��Cl������C����
D�����κ����������ӣ�����ˮ�����������������壬��������ˮ������D��ȷ��
��ѡC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������������ε�Ksp����ɫ���ұ�������˵����ȷ����
AgCl | Ag2CrO4 | AgI | |
��ɫ | �� | ש�� | �� |
Ksp | 1.8��10-10 | 1.0��10-12 | 8.5��10-17 |
A��AgCl��Ag2CrO4��AgI������Һ��c(Ag+)���μ�С
B��Ag2CrO4������Һ��c��Ag+��ԼΪ1.0��10-6mol��L-1
C����AgCl����Һ��������KI��Һ���������ɰ�ɫת��Ϊ��ɫ
D�����Ũ�ȵ�KCl��K2CrO4�����Һ�еμ�����AgNO3��Һ��������ש��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ��������ϩ��A������������B����ʯ�ͷ���C����װ�ã�
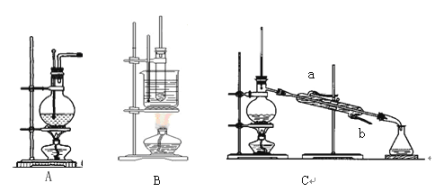
��1��д����ȡ��ϩ���������Ļ�ѧ����ʽ��___________��_________��
��2����A�� Cʵ����������Ƭ����Ŀ����_______________��
��3����������B���������ķ�����__________��
��4����ʯ�ͷ���ʵ���У�����ˮ������Ӧ��_______��______��������ĸa��b����
��5��ʵ��������ϩʱ���������д̼�����ζ�����������Ϊ���������ϩ����ʵ��ĸ��ţ��ɽ�����ͨ��_______��Һ��ȥ������Ӧû�м�ʱ������170�棬���ܴ�������Ҫ��������____�������ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(һ)ijʵ��С����������װ��(���̶ֹ�װ����)���е�����Ƶķ�Ӧ����̽�����������ʼ���ѧʽ����ش��������⡣
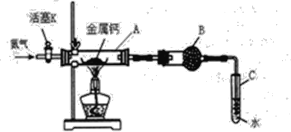
��1����Ӧ������ĩ�˵��ܱ�������Թ�C��ˮ�У�Ŀ����____��(����ĸ)
A.���շ�Ӧ��ʣ��ĵ���
B.����ͨ�����������
C.��ֹ�����е������������뷴Ӧװ�ã����ŷ�Ӧ
��2����С��ͬѧ��Ϊ������Ӧ��������ϵ�������������Ļ�ѧʽ�����ݼ�¼���£�
A������m0/g | A��Ƶ�����m1/g | A����������m2/g |
14.80 | 15.08 | 15.15 |
��ͨ������õ���ѧʽCaxN2������x=____��
��С��ͬѧ�������ϵ�֪����ΪCa3N2������ˮǿ�ҷ�Ӧ����д��Ca3N2��ˮ��Ӧ�Ļ�ѧ����ʽ_____��
�����������仯����������������й㷺Ӧ�ã���ش��������⣺
��1��������FeS2�������������ұ����������Ҫԭ�ϡ�����һ����ӦΪ3FeS2+8O2![]() 6SO2+Fe3O4������3molFeS2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_____��
6SO2+Fe3O4������3molFeS2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_____��
��2��FeCl3������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ____��
��3����һ������Fe2O3����160mL 5molL-1�����У��ټ���һ�������ۣ�����ǡ����ȫ�ܽ⣬�ռ�������2.24L����״����������⣬��ҹ����Fe3+����μӷ�Ӧ�����۵�����Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܴ���H����Al3����NH![]() ��Mg2����Ba2����I����CO
��Mg2����Ba2����I����CO![]() ��SO
��SO![]() ��NO
��NO![]() �е������֣���ȡ������Һ��������һϵ��ʵ�飺
�е������֣���ȡ������Һ��������һϵ��ʵ�飺
![]()
�����й��ж���ȷ����(����)
A. ԭ��Һ��һ����Mg2����H����NH![]() ��I����SO
��I����SO![]()
B. ԭ��Һ��һ��û��Ba2����CO![]() ��NO
��NO![]() ��Al3��
��Al3��
C. �������ķ�Ӧֻ��Ba2����2OH����CO2===BaCO3����H2O
D. ����A��B֮��϶����ܷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1mol��ѧ�����յ��������γ�1mol��ѧ���ͷŵ�������Ϊ���ܣ��������ʵļ������±���ʾ��
��ѧ�� | C-H | C=O | N-H | C-N | H-O |
���ܣ�kJ/mol�� | a | b | c | d | e |
��ȩ�Ʊ�������Ʒ�ķ�Ӧ���£�6![]() (g) + 4NH3(g) ��
(g) + 4NH3(g) ��  + 6H2O(l)
+ 6H2O(l)
�÷�Ӧ���SHΪ �� ��
A. 6��a+b+c-d-e��kJ/molB. 6��d+e-a-b-c��kJ/mol
C. 6��b+2c-2d-2e��kJ/molD. 6��2d+2a+2e-b-3c��kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾ƥ�֣�����ˮ���ᣬ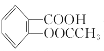 ����������Ӧ����㷺�Ľ��ȡ���ʹ�Ϳ���ҩ������ˮ���������ֽ⣬�ֽ��¶�Ϊ128����135����ijѧϰС����ʵ������ˮ���ᣨ���ǻ������ᣩ�������[��CH3CO��2O]Ϊ��Ҫԭ�Ϻϳɰ�˾ƥ�֣���Ӧԭ�����£�
����������Ӧ����㷺�Ľ��ȡ���ʹ�Ϳ���ҩ������ˮ���������ֽ⣬�ֽ��¶�Ϊ128����135����ijѧϰС����ʵ������ˮ���ᣨ���ǻ������ᣩ�������[��CH3CO��2O]Ϊ��Ҫԭ�Ϻϳɰ�˾ƥ�֣���Ӧԭ�����£�
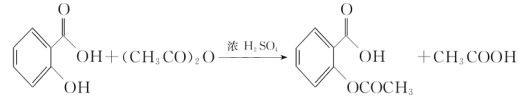
�Ʊ����������������£�
![]()
��Ҫ�Լ��Ͳ�Ʒ�������������±���ʾ��
���� | ��Է������� | �۵��е㣨�棩 | ˮ |
ˮ���� | 138 | 158���۵㣩 | �� |
������ | 102 | 139.4���е㣩 | ��ˮ�� |
����ˮ���� | 180 | 135���۵㣩 | �� |
�����������Ϣ�ش��������⣺
��1���Ʊ���˾ƥ��ʱ��Ҫʹ�ø����������ԭ����_____��
��2���ϳɰ�˾ƥ��ʱ������ʵļ��ȷ�����_____��
��3���ᴿ�ֲ�Ʒ�������£����Ȼ���װ����ͼ��
![]()
��ʹ���¶ȼƵ�Ŀ���ǿ��Ƽ��ȵ��¶ȣ���ֹ_____��
������ˮ������������_____������a������b������
�����ȹ��˵�ԭ����_____��
������˵����ȷ����_____����ѡ����ĸ����
a�������ᴿ�������������������������ܼ�
b�������ᴿ�ֲ�Ʒ�ķ������ؽᾧ
c�����������ᴿ���̿��Եó���˾ƥ�������������е��ܽ�ȵ���ʱ��
d����������ɫʯ����Һ�жϲ�Ʒ���Ƿ���δ��Ӧ���ˮ����

��4����ʵ����ԭ��������2.0gˮ���ᡢ5.0mL������������1.08g/cm3�������ճƵò�Ʒ����Ϊ2.2g������������ˮ����IJ���Ϊ_____���ðٷ�����ʾ��С�����һλ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�ڴ����������¿ɷ���������Ӧ���䷴Ӧ����Ϊ��PdCl2+C2H4+H2O![]() Pd+2HCl+CH3CHO��Pd+2CuCl2 PdCl2+2CuCl��4CuCl+4HCl+O2 4CuCl2+2H2O������˵���������
Pd+2HCl+CH3CHO��Pd+2CuCl2 PdCl2+2CuCl��4CuCl+4HCl+O2 4CuCl2+2H2O������˵���������
A. �����ӿ췴Ӧ���ʵ�ԭ����ͨ���ı䷴Ӧ·�������˻��
B. �ô�������Ӧ���ܷ���ʽ��2C2H4+O2![]() 2CH3CHO
2CH3CHO
C. �ô��������̿�����ˮ�����½���
D. CuCl2��PdCl2�Ļ����Һ����Ϊ�÷�Ӧ�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����a mol Cl2 ͨ�뺬b mol FeBr2����Һ�У���0< a / b��1/2 ʱ����Ӧ�����ӷ���ʽΪ��2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ��д����2�����ܷ��������ӷ���ʽ��
�ٵ� a / b =1ʱ___���ڵ�a / b��3/2ʱ_______��
��2���۲췴Ӧ�٢ڣ��ܽ���ɣ���ģ�·�Ӧ�٢ڷ���ʽ����������⣺��Al(OH)3 ��H2O![]() Al(OH)4�D + H+����NH3+H2O
Al(OH)4�D + H+����NH3+H2O![]() NH4+ + OH�D��
NH4+ + OH�D��
��A����֪B(OH)3��һԪ���ᣬ��д������뷽��ʽ�� ___��
��B��N2H4�Ƕ�Ԫ��������ֲ����У���һ�����뷽��ʽN2H4+H2O![]() N2H5+ + OH�D����д����ڶ������뷽��ʽ_____��
N2H5+ + OH�D����д����ڶ������뷽��ʽ_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com