
【题目】某溶液中可能存在H+、Al3+、NH![]() 、Mg2+、Ba2+、I-、CO
、Mg2+、Ba2+、I-、CO![]() 、SO
、SO![]() 、NO
、NO![]() 中的若干种,现取适量溶液进行如下一系列实验:
中的若干种,现取适量溶液进行如下一系列实验:
![]()
下列有关判断正确的是( )
A. 原溶液中一定有Mg2+、H+、NH![]() 、I-、SO
、I-、SO![]()
B. 原溶液中一定没有Ba2+、CO![]() 、NO
、NO![]() 、Al3+
、Al3+
C. 步骤③的反应只有Ba2++2OH-+CO2===BaCO3↓+H2O
D. 气体A、B之间肯定不能发生反应
【答案】A
【解析】
加Ba(NO3)2后生成的气体是NO,由此说明原溶液中含有H+、I-,酸性溶液中CO32-不存在,I-和NO3-不能同时存在,试液中加入过量硝酸钡溶液,生成气体证明一定含有I-、则原溶液中一定不存在NO3-,气体为NO,沉淀A为BaSO4,原溶液中一定不存在Ba2+,一定存在SO42-,溶液A中加入过量氢氧化钠溶液生成气体B为NH3,确定原溶液中含有NH4+,沉淀B为Mg(OH)2,由于溶液B中含有Ba2+,OH-,溶液B加入少量二氧化碳发生反应③,生成的沉淀一定含有BaCO3沉淀,可能生成沉淀Al(OH)3,原溶液中不一定含有Al3+。
A、加Ba(NO3)2后生成的气体是NO,由此说明原溶液中含有H+、I-;由还有沉淀生成知溶液中还有SO![]() ,根据离子间的共存关系知溶液中没有CO
,根据离子间的共存关系知溶液中没有CO![]() 、Ba2+;由②知原溶液中有NH
、Ba2+;由②知原溶液中有NH![]() 、Mg2+;由于溶液B中含有Ba2+、OH-,故通入少量CO2时生成的沉淀C中一定有BaCO3,故无法确定原溶液中是否有Al3+,故A正确;
、Mg2+;由于溶液B中含有Ba2+、OH-,故通入少量CO2时生成的沉淀C中一定有BaCO3,故无法确定原溶液中是否有Al3+,故A正确;
B、原溶液中一定没有的离子为:Ba2+、CO32-、NO3-,无法确定原溶液中是否有Al3+,故B错误;
C、步骤③中反应的离子方程式可能为Ba2++2OH-+CO2=BaCO3↓+H2O,或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故C错误;
D、气体A是NO,气体B是NH3,二者在一定条件下反应可得到N2与H2O,故D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下,请回答下列问题:

(1)步骤①的作用是清洗废铁屑表面的油污,其中加热的目的是____________。
(2)写出步骤②中生成![]() 的离子方程式______________________。(写一个即可)
的离子方程式______________________。(写一个即可)
(3)步骤③中“氯气”不引入杂质但有毒,可以用___________代替(填化学式)。
(4)若溶液B中只含有![]() 而不含
而不含![]() ,可证明该事实的实验操作是__________。
,可证明该事实的实验操作是__________。
(5)步骤⑤产生金属铜的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达不正确的是 ( )
A. 向FeCl3溶液滴加HI溶液:2Fe3++2I-== 2Fe2++I2
B. CuSO4溶液吸收H2S 气体:Cu2++H2S == CuS↓+2H+
C. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH- == NO![]() +NO
+NO![]() +H2O
+H2O
D. 向NH4Al(SO4)2溶液中滴加少量Ba(OH)2溶液:2NH4++Ba2++SO42-+2OH—= BaSO4↓+2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
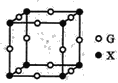
(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH![]() 、Al3+、SO
、Al3+、SO![]() 、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
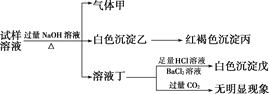
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样溶液中肯定有NH![]() 、SO
、SO![]() 和Fe2+
和Fe2+
B. 试样溶液中一定没有Al3+
C. 若气体甲在标准状况下体积为0.448 L,沉淀丙和沉淀戊分别为1.07 g和4.66 g,则可判断试样溶液中还有Cl-
D. 该盐在工业上可以用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3﹣丁二烯和2﹣丁炔分别与氢气反应的热化学方程式如下:CH2=CH﹣CH=CH2 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-236.6kJ/mol CH3﹣C≡C﹣CH3 (g)+2H2 (g)→ CH3CH2CH2CH3 (g) H=-272.7kJ/mol。由此不能判断 ( )
A. 1,3﹣丁二烯和2﹣丁炔稳定性的相对大小
B. 1,3﹣丁二烯和2﹣丁炔分子储存能量的相对高低
C. 1,3﹣丁二烯和2﹣丁炔相互转化的热效应
D. 一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上海水淡化的主要方法有蒸馏法、电渗析法、反渗透法等。电渗析法是在直流电源作用下通过离子交换膜对海水进行处理(原理如图所示);反渗透法是利用压强差使海水一侧的水分子通过渗透膜进入淡水一侧,从而得到淡水和浓缩的盐溶液(原理如图所示)。下列说法正确的是
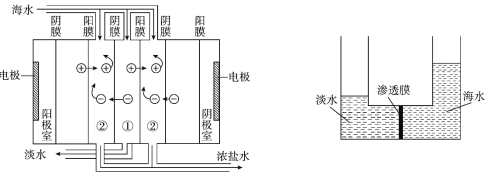
A. 蒸馏法、电渗析法、反渗透法均不发生化学反应
B. 反渗透法所用渗透膜的微孔直径范围是1~100nm
C. 蒸馏法具有设备简单、成本低等优点
D. 浓缩的盐溶液可用于提取或制备食盐、镁、溴等物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
B. 以石墨作电极电解氯化铝溶液:2Cl-+ 2H2O![]() 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
C. Ca(C1O)2溶液中通人过量的SO2气体:ClO-+SO2+H2O=HSO3-+HClO
D. 向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com