
【题目】下列离子方程式书写正确的是 ( )
A. 氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
B. 以石墨作电极电解氯化铝溶液:2Cl-+ 2H2O![]() 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
C. Ca(C1O)2溶液中通人过量的SO2气体:ClO-+SO2+H2O=HSO3-+HClO
D. 向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
【答案】D
【解析】
A.氯化钙溶液中通入二氧化碳,二者不发生反应,故A错误;
B.用石墨作电极电解AlCl3溶液生成氢氧化铝、氢气和氯气,离子方程式:2Al3++6Cl-+6H2O![]() 2Al(OH)3↓+3H2↑+3Cl2↑,故B错误;
2Al(OH)3↓+3H2↑+3Cl2↑,故B错误;
C.Ca(ClO)2溶液中通人过量的SO2气体,二者发生氧化还原反应,正确的离子方程式为:Ca2++2ClO-+2H2O+2SO2═CaSO4↓+SO42-+4H++2Cl-,故C错误;
D.向明矾溶液中加入氢氧化钡溶液至沉淀质量最大时,反应生成硫酸钡沉淀和偏铝酸钾,反应的离子反应为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】某溶液中可能存在H+、Al3+、NH![]() 、Mg2+、Ba2+、I-、CO
、Mg2+、Ba2+、I-、CO![]() 、SO
、SO![]() 、NO
、NO![]() 中的若干种,现取适量溶液进行如下一系列实验:
中的若干种,现取适量溶液进行如下一系列实验:
![]()
下列有关判断正确的是( )
A. 原溶液中一定有Mg2+、H+、NH![]() 、I-、SO
、I-、SO![]()
B. 原溶液中一定没有Ba2+、CO![]() 、NO
、NO![]() 、Al3+
、Al3+
C. 步骤③的反应只有Ba2++2OH-+CO2===BaCO3↓+H2O
D. 气体A、B之间肯定不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36,Ksp(MnS)=2.5×10-13,常温下三种物质在水中的沉淀溶解平衡线如图所示(X表示Fe、Cu、Mn)。下列说法正确的是

A. 曲线Ⅰ表示CuS的溶解平衡曲线
B. MnS在a点溶液中的溶度积等于在b点溶液中的溶度积
C. c点与d点溶液中S2-的物质的量浓度相等
D. 向含有XS固体的d点溶液中滴加稀硫酸至过量可使固体逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出实验过程中总的化学方程式______________;在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_______反应。(填“吸热”或“放热”).
(2)甲是热水浴,乙是冷水浴,但两个水浴作用不相同,①甲的作用是___________;②乙的作用是____________________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有___________ 。要除去该物质,可先在混合液中加入__________(填写字母),然后再通过蒸馏即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是 ( )
A. 100 mL的盐酸中HCl的物质的量浓度为7.5 mol·L-1
B. 生成的H2S气体在标准状况下的体积为2.24 L
C. 该磁黄铁矿FexS中,x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式。
①当 a / b =1时___;②当a / b≥3/2时_______。
(2)观察反应①②,总结规律,并模仿反应①②方程式完成下列问题:①Al(OH)3 +H2O![]() Al(OH)4― + H+;②NH3+H2O
Al(OH)4― + H+;②NH3+H2O![]() NH4+ + OH―。
NH4+ + OH―。
(A)已知B(OH)3是一元弱酸,试写出其电离方程式: ___;
(B)N2H4是二元弱碱,其电离分步进行,第一步电离方程式N2H4+H2O![]() N2H5+ + OH―,试写出其第二步电离方程式_____。
N2H5+ + OH―,试写出其第二步电离方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】看下列仪器装置图,回答下列问题:
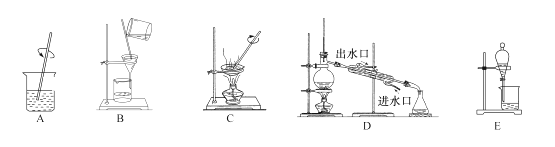
(1)粗盐的提纯需要上面的哪些装置?___________(填字母符号)
(2)分离以下混合物应该选择使用什么装置?(填字母符号)
①酒精和水:___________,
②食盐和水:___________,
③二氧化锰和KCl:___________,
④花生油和水:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。

(1)仪器乙的名称是________;其中,与自来水进水管连接的接口编号是________。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________。实验过程中,为减少PCl5的生成,应控制____________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________。若滴定终点时俯视读数,则PCl3的质量分数________(填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学。根据题意填空:
(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) ![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com