
【题目】在25’C时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
平衡浓度/mol/L | 0. 05 | 0. 05 | 0.1 |
下列说法错误的是
A. 反应达衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,发生反应:3B(s)![]() 2C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
2C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变②混合气体的密度不变③C(g)的物质的量浓度不变④容器内C、D三种气体的浓度之比为2:1⑤单位时间内生成n molD,同时生成2n mol C.⑥单位时间内生成2n molC,同时消耗n mol D.⑦混合气体中C的体积分数不变
A. ①②③ B. ③④⑥ C. ①②③⑥⑦ D. ①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 38.4g铜跟适量的浓硝酸反应,铜完全作用后,共收集到气体22.4L(标准状况),反应消耗的HNO3的物质的量可能是
A.1.0molB.1.6 molC.2.2 mol D.2.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护的角度考虑,大量制取硝酸铜最宜采用的方法是( )
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu ![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
D.Cu ![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对增生性瘢痕早期进行 ![]() Sr(锶)干预可取得较好效果.下列说法正确的是( )
Sr(锶)干预可取得较好效果.下列说法正确的是( )
A.Sr为于第4周期ⅡA 族
B.![]() Sr核内中子数与质子数之差为14
Sr核内中子数与质子数之差为14
C.![]() Sr与
Sr与 ![]() Y互为同位素
Y互为同位素
D.![]() Sr的核内质子数为38,Sr元素的相对原子质量为90
Sr的核内质子数为38,Sr元素的相对原子质量为90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

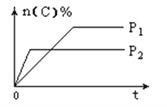
A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀的认识中正确的是
A.金属被腐蚀时发生的全部是氧化还原反应
B.金属腐蚀可以分为化学腐蚀和电化腐蚀,只有化学腐蚀是氧化还原反应
C.防止钢铁被腐蚀不需要避免它受潮
D.钢铁发生腐蚀时以发生化学腐蚀为主
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②![]() Na2FeO2+
Na2FeO2+![]() NaNO2+
NaNO2+![]() H2O―→
H2O―→![]() Na2Fe2O4+
Na2Fe2O4+![]() NH3↑+
NH3↑+![]() NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O![]() Fe3O4+4NaOH
Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为_____________。
(2)上述反应①中氧化剂为______,被氧化的物质是______。若有2 mol Na2FeO2生成,则反应①中有________mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是________(填字母)。
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com