
300mL某浓度的NaOH溶液中含有60g溶质,现欲配制1mol/L NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1∶4 B.1∶5 C.2∶1 D.2∶3
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
根据反应Br+H2 HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是( )
HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是( )
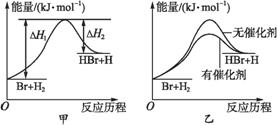
A.正反应吸热
B.加入催化剂,该化学反应的反应热不变
C.加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的天然气,
理论上所获得的热值,前者大约是后者的多少倍( )
A.0.8 B.1.3 C.3.1 D.0.32
查看答案和解析>>
科目:高中化学 来源: 题型:
恒容密闭容器中,发生反应H2(g)+Br2(g) 
 2HBr(g) ΔH<0。恒温下
2HBr(g) ΔH<0。恒温下
发生反应,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述
反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁过程中发生的主要反应为:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
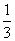 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
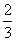 Fe(s)+CO2(g).
Fe(s)+CO2(g).
该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各
1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率
v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A.减少Fe的量 B.增加Fe2O3的量
C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L
B.制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况)
C.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为 2×6.02×1023
D.10g 98%硫酸(密度为1.84g/cm3)与10 mL 18.4 mol/L硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关的叙述正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
D.“血液透析”原理与胶体的性质无关
查看答案和解析>>
科目:高中化学 来源: 题型:
某一元有机酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数比为a:b,则HA的电离度(即转化率)是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是
,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚(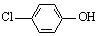 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
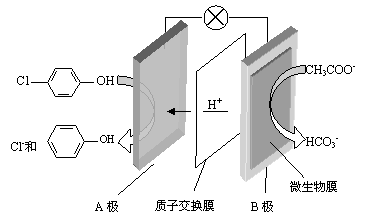
①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
|
 |  | ||||
 |
 |
① 阳极的电极反应式为 。
② 简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g? mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com