
����Ŀ�����и���ʵ������Һ���ȱ���ǵ��ǣ�������
A. 0.1mol��LNa2S2O3��H2SO4��5mL����ˮ5mL����Ӧ�¶�10��
B. 0.1mol��LNa2S2O3��H2SO4��5mL����ˮ10mL����Ӧ�¶�10��
C. 0.1mol��LNa2S2O3��H2SO4��5mL����ˮ5mL����Ӧ�¶�30��
D. 0.2mol��LNa2S2O3��H2SO4��5mL����ˮ10mL����Ӧ�¶�30��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㷺���ڷ�֯��ҵ��������������(Na2S2O4)���׳Ʊ��շۣ���һ��ǿ��ԭ����������ˮ�����������Ҵ����ڼ��Խ������ȶ���
��.��ҵ���Ʊ������������Ƶ��������£�

��ش��������⣺
��1��������еĻ�ѧ����ʽΪ___________________________________��
��2��������г���Ϊ_________________________________���ѧʽ����
��3��������м���NaCl �����������______________________________����������շ۷���Ϊ_______��ϴ�ӡ����ϴ�������Լ���___________________________��
��.��ҵ��Ҳ������ͼװ�õ��NaHSO3��Һ��Na2S2O4��
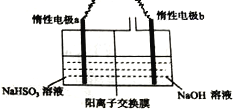
��1�����Ե缫a���ӵ�Դ��_________���������������������缫��ӦʽΪ________________��
��2�������Ӹ�Ĥ����ò��������������ƣ���ԭ����____________________________��
��.̽��Na2S2O4�����ʣ�
ij����С�鳣���²ⶨ0.050 molL-1Na2S2O4��Һ�ڿ����е�pH�仯����ͼ��ʾ��
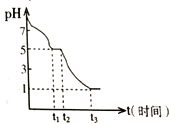
��1��0-t1����Ҫ����HSO3-������pH�仯ͼ��д��0- t1������Ӧ�����ӷ���ʽΪ______________��
��2����t1ʱ��Һ��Na2S2O4ȫ����������NaHSO3����ʱ��Һ��c(SO32-)-c(H2SO3) =__________ molL-1���������ֵ����������Һ����仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú������Ҫ�ĺ���������H2S�Լ�COS���л���ú��ȼ�պ������ʻ�ת����SO2�Ӷ����������Ⱦ�����ú����H2S���ѳ��̶��ѳ�Ϊú���ྻ�ȵ�һ����Ҫָ�ꡣ��ش���������:
��1��H2S��ˮ��Һ�еĵ��뷽��ʽΪ___________��
��2���ѳ�ú����COS�ķ�����Br2��KOH��Һ��������H2��ԭ����ˮ�ⷨ�ȡ�
��COS�ķ��ӽṹ��CO2���ƣ�COS�ĽṹʽΪ___________��
��Br2��KOH��Һ��COS����Ϊ�����ε����ӷ���ʽΪ______________��
����֪��H2��COS��H2S��CO��ȼ��������Ϊ285kJ/mol��299kJ/mol��586kJ/mol��283kJ/mol��H2��ԭCOS�����ķ�ӦΪH2(g)+COS(g)=H2S(g)+CO(g)���÷�Ӧ�Ħ�H=_________kJ/mol��
���û��Ԧ�-Al2O3��COSˮ�ⷴӦΪCOS(g)+H2O(g) ![]() CO2(g)+H2S(g) ��H<0����ͬ�������ڴ�������ͣ����ͬʱ��ʱ����ͬ�¶���COS��ת���ʣ�δ�ﵽƽ�⣩��ͼ1��ʾ��ij�¶��£�COS��ƽ��ת������n(H2O)/n(COS)�Ĺ�ϵ��ͼ2��ʾ��
CO2(g)+H2S(g) ��H<0����ͬ�������ڴ�������ͣ����ͬʱ��ʱ����ͬ�¶���COS��ת���ʣ�δ�ﵽƽ�⣩��ͼ1��ʾ��ij�¶��£�COS��ƽ��ת������n(H2O)/n(COS)�Ĺ�ϵ��ͼ2��ʾ��

��ͼ1��֪�������������ʱ��Ӧ���¶�ԼΪ______��COS��ת�����ں����½���ԭ����_______________________________________����ͼ2��֪��P��ʱƽ�ⳣ��K=______������2λ��Ч���֣���Q��ת���ʸ���P���ԭ����__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D����ѧ�����Ļ���������ᴿ�Ļ���װ�á�

����ݻ���������ᴿԭ�����ش�������ʵ������Ҫʹ������װ�á���A��B��C��D�����ʵ��Ŀո��С�
��1����ȥCa(OH)2��Һ��������CaCO3 ___________����2��������ˮ��ȡ����ˮ ___________����3������ֲ���ͺ�ˮ ___________����4���뺣ˮɹ��ԭ��������� ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ǧ���صĹ���ԭ��Ϊ��Pb��PbO2��2H2SO4![]() 2PbSO4��2H2O��������ͼװ�ý��е��(���Һ����)����õ�Ǧ������ת��0.4 mol����ʱ���缫����������11.2 g����ش��������⡣
2PbSO4��2H2O��������ͼװ�ý��е��(���Һ����)����õ�Ǧ������ת��0.4 mol����ʱ���缫����������11.2 g����ش��������⡣

��1��A��Ǧ���ص�________����Cu�缫��________�����ŵ�����е��Һ���ܶ�________(������С��������������������)��
��2��Ag�缫�ĵ缫��Ӧʽ��______________________________���õ缫�ĵ缫���ﹲ________g��
��3��Cu�缫�ĵ缫��Ӧʽ��______________________________��CuSO4��Һ��Ũ��________(������С��������������������)
��4����ͼ��ʾ�����й�����ij����(������x)��ʱ��ı仯���ߣ���x��ʾ________��

a����U�ι��в�������������
b����U�ι������������ļ�����
c����U�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۹�������Ŀǰ���߷����������о����ȵ㣬һ���øֹܳ��ķ���������Ҫ�ɷ�Fe3O4������C��SiO2��Ϊԭ���Ʊ����������£�
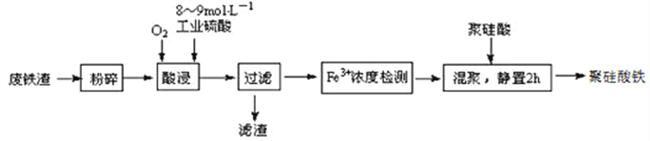
��֪����һ���¶������ʱFe3+��pH=2��ʼ������pH=3.7������ȫ
��1�����������С����顱��Ŀ����___________________________________________________��
��2��������������˵���Ũ�ȡ�Һ�̱ȡ�����¶ȡ��������ȣ���������¶ȶ�����ȡ�ʵ�Ӱ�����±���ʾ��
�¶ȡ� | 40 | 60 | 80 | 100 | 120 |
����ȡ�� | 50 | 62 | 80 | 95 | 85 |
����д�����������Fe3O4���������ӷ�Ӧ����ʽ__________________________________��
���������ʱӦ������Һ��pH____________����ԭ����_________________________________��
�۵�����¶ȳ���100��ʱ������ȡ�ʷ�����С����ԭ����___________________��
��3���������˲������Һ����Ҫ�ɷ�Ϊ____________���ѧʽ����
��4��Fe3+Ũ�ȶ�������������SnCl2��Fe3+��ԭΪFe2+�������������£�����K2Cr2O7����Һ�ζ�Fe2+��Cr2O72-����ԭΪCr3+�����õζ���Ӧ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�д��ڶ��ַ��Ӻ����ӣ������ڲ�ͬ�ķ�Ӧ�б��ָ��Ե����ʣ�����ʵ������ͽ���һ ������ȷ����
A. ������ɫ��������ɫ��˵����Һ���� Cl2 ����
B. ��Һ���ֻ���ɫ�����д̼�����ζ��˵���� Cl2 ����
C. �ȼ��������ữ���ټ�����������Һ������ɫ������˵���� Cl������
D. ������ˮ������������Խ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��Դ��ָʹ�ù����в��ŷŻ��ŷż�����Ⱦ�����Դ����һ����Դ�е�ˮ�ܡ������ܡ���Ȼ���ȣ�������Դ�еĵ��ܡ����ܵȡ�������Դ������ɫ��Դ����
��̫���ܢڷ��ܢ�ʯ�͢�ú�ݳ�ϫ�ܢ�ľ��
A.�٢ڢ�B.�ۢܢ�C.�ܢݢ�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ô��Σ���Ca2+��Mg2+��SO42-�����ʣ�Ϊ��Ҫԭ�ϲ����������ƳǷ�����������ͻ���NH4Cl������������ͼ��ʾ�������й�˵������ȷ����

A. �Դ�����Һ���ӿ����μ���NaOH��Na2CO3��BaCl2���ټ������������ҺpH
B. ���οɲ��ó��Ӻ��ؽᾧ�ȹ����ᴿ
C. ����ͼ�е�ϵ�в������õ��IJ������������в��������ձ���©����������
D. �������еõ��ľ����õ����ܽ�ȵIJ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com