
| A、金属元素的单质与非金属元素的单质化合 |
| B、只限于ⅦA和ⅠA的元素之间 |
| C、活泼的金属元素与活泼的非金属元素相互化合 |
| D、任意两种元素化合均可形成离子键 |


科目:高中化学 来源: 题型:
| A、器内压强不随时间变化而变化 |
| B、反应器内A、B、C、D物质的量比为1:3:3:1 |
| C、生成A的速率和生成的D的速率相等 |
| D、生成 1mol A同时有3 mol C被消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池工作时,锌是负极,发生氧化反应 |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| D、电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、E(4s)>E(3s)>E(2s)>E(1s) |
| B、E(3d)>E(4s)>E(3p)>E(3s) |
| C、E(5s)>E(4f)>E(4s)>E(3d) |
| D、E(5s)>E(4s)>E(4f)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、核电荷数 | B、核外电子数 |
| C、电子层数 | D、原子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、d<c<a<b |
| B、c<d<b<a |
| C、d<a<b<c |
| D、c<d<a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
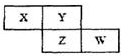 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氩原子的氩气在标准状况下的体积约为11.2 L |
| B、17g 氨气含有的电子数为10NA |
| C、18g D2O中含有的氧原子数为NA |
| D、标准状况下,22.4LCCl4含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Cl-、NO3- |
| B、Mg2+、Ca2+、SO42-、OH- |
| C、Fe2+、Fe3+、H+、NO3- |
| D、Ba2+、Fe3+、Cl-、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com