
| A、电池工作时,锌是负极,发生氧化反应 |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| D、电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |


科目:高中化学 来源: 题型:
| A、相同温度下,1 mol/L氨水溶液与0.5 mol/L氨水溶液中c(OH-) 之比为2:1 |
| B、NH4Cl 溶液中,c(NH4+)=c(Cl -) |
| C、向0.1 mol/L NaNO3溶液中滴加稀盐酸,使溶液pH=5,此时混合液中c(Na+)=c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
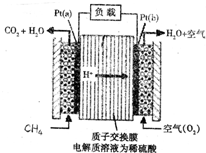 科学家预言,燃料电池将是21世纪获得电源的重要途径.近几年开发的甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图:
科学家预言,燃料电池将是21世纪获得电源的重要途径.近几年开发的甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、反应物和生成物各自具有的总能量决定反应是放热还是吸热 |
| C、任何放热反应在常温条件下一定能发生 |
| D、镁和氧气反应生成氧化镁后,生成物能量明显升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属元素的单质与非金属元素的单质化合 |
| B、只限于ⅦA和ⅠA的元素之间 |
| C、活泼的金属元素与活泼的非金属元素相互化合 |
| D、任意两种元素化合均可形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4molFe 在5molCl2中点燃反应:5Cl2+4Fe═2FeCl2+2FeCl3 |
| B、氯化铁溶液中通入硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| D、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com