
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 3 |
| 2 |
| 1.6mol |
| 2mol |
| ||||
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
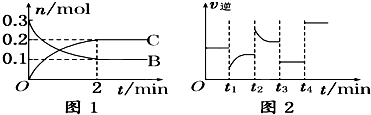
| A、反应开始2分钟内,v(B)=0.05mol/(L?min) |
| B、t1时改变的条件可能是减小了反应物的浓度 |
| C、t2时可能升高了温度 |
| D、t3时改变的条件可能是降压,此时c(B)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4℃的纯水pH为7 |
| B、水的电离方程式为:H2O?2H++O2- |
| C、重水(D2O)中,质量数是质子数的两倍 |
| D、相同质量的水具有的能量:固体>液体>气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、器内压强不随时间变化而变化 |
| B、反应器内A、B、C、D物质的量比为1:3:3:1 |
| C、生成A的速率和生成的D的速率相等 |
| D、生成 1mol A同时有3 mol C被消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧 |
| B、SO2氧化为SO3需要高压,可以提高SO2的转化率 |
| C、SO2氧化为SO3需要使用催化剂,可以提高SO2的转化率 |
| D、用98.3%的浓硫酸吸收SO3,可以提高SO3的吸收效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
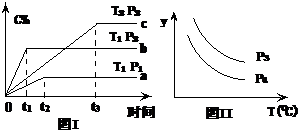 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,| A、P3<P4 y轴表示A的转化率 |
| B、P3>P4 y轴表示B的百分含量 |
| C、P3>P4 y轴表示混合气体的密度 |
| D、P3>P4y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、只有①③⑤ |
| C、只有②④⑥ | D、只有①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池工作时,锌是负极,发生氧化反应 |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| D、电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
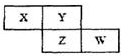 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com