
【题目】已知反应:HCl + NH3= NH4Cl(固体)如下图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度。下列说法正确的是( )
![]()
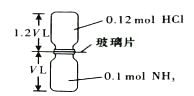
A. 反应后瓶内压强是反应前的1/10 B. 装置中氢元素的总质量为0.42 g
C. 生成物的分子数目为0.1 NA D. 反应结束后,两个集气瓶很容易分开
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是( )


A. 图1表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1、K2,则T1<T2,K1>K2
B. 图2所示,反应:X(g)+2Y(g)![]() 3Z(g),b的温度比a高
3Z(g),b的温度比a高
C. 图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D. 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+OH─(aq)=H2O(l) △H=-57.3kJ ·mol-1。按照图1所示装置进行实验。
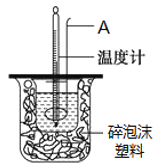
(1)仪器A的名称是________。
(2)碎泡沫塑料的作用是________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L-1 CH3COOH溶液、50mL 0.55 mol·L-1 NaOH溶液进行实验,测得的中和热△H________-57. 3 kJ ·mol-1(填“>”“=”或“<”),原因是 ________。
Ⅱ.中和滴定
(1)用_______量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为________ (保留两位有效数字)。滴定达到终点的标志是________。
(2)若某次滴定结束时,滴定管液面如图2所示,则终点读数为________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L正戊烷中含有的碳原子数为0.5 NA
B. 1L0.1mol·L-1NaHCO3溶液中所含HCO3-的数目为0.1NA
C. 一定条件下,0.1mol CO与0.1mol H2O(g)充分反应,生成H2的分子数为0.1NA
D. 在反应:3FeS2+12C+8O2=Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇。已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)=2H2O(l) △H=- 283.0kJ/mol;
②2CH3OH (1)+3O2=2CO2(g)+4H2O(1) △H=- 726.0kJ/mol。
(1)写出二氧化碳与氢气合成甲醇液体的热化学方程式____。
(2)已知:CO2 (g)+3H2 (g)=CH3OH (g)+H2O(g) △H=- 49.0kJ/mol,将6molCO2和8mol H2充入4L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线),图中数据a(l,6)表示在1min时H2的物质的量是6mol。

①b点正反应速率____(填“大于”“等于”或“小于”)逆反应速率。此温度下该反应的平衡常数为____。
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅱ对应的实验条件改变是____,体积不变再充入3 mol CO2和4mol H2,H2O(g)的体积分数____(填“增大”“不变”或“减小”)
Ⅱ.粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)
(1)铅蓄电池的负极电极反应式为 ___。
(2)粗镍提纯的阴极反应式为 ___。电解结束后,阳极附近产生的沉淀物的主要成分为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol·L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列叙述错误的是

A. C点溶液中含有NaHA和Na2A
B. NaHA溶液中水的电离程度比Na2A溶液中小
C. B点,c (Na+)=2[c (H2A)+c (HA)+c (A2-)]
D. D点,c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(N2)=0.05 mol·L-1·s-1 B. v(H2)=0.3 mol·L-1·min-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式书写正确的是
A.铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+
B.硫化钠溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.氯水具有漂白性:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D.工业上利用电解饱和食盐水制氯气:2H++2Cl-![]() H2↑+Cl2↑
H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锂(Li2O)是锂电池工业的重要原料。以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:
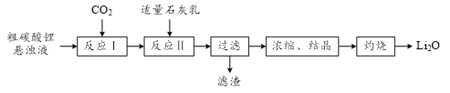
注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)①反应Ⅱ生成LiOH的化学方程式为______。
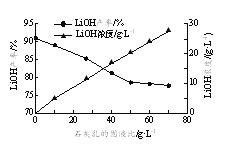
②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1,若固液比过低对后续操作的不利影响是______。
(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。
①LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O得纯度无影响,其原因是______。
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是______。铁坩埚中发生反应的化学方程式为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com